
Открытия, способствовавшие утверждению и развитию учению Жерара
Руководствуясь правилом четности, Жерар и Лоран мсправили много неверных эмпирических формул органических соединений: жирных кислот, гликоколя, лейцина, анисовой, хинной и винной кислот, фосфида азота, пшена, теобромина, хлорпикрина, кодеина и т. д. В большинстве случаев эти исправления были правильными.
Интересно отметить такой случай. Воскресенский открыв хинон и его производные (1838), придал хинону формулу C12H8O4 [40], вполне соответствующую современной формуле С6Н4O2. Через шесть лет Велер выразил состав хинона формулой C15H10O5, а еще позже исправил ее на C25H8O8, принимая С = 6 и О = 8. В 1845 г. Жерар на основе своего правила четности доказал, что формула Велера ошибочна, а формула Воскресенского правильна, но ее надо уменьшить вдвое; Лоран подтвердил мнение Жерара опытным путем [1, стр. 381]. Позже Велер признал правильность формулы Воскресенского, но, сообщая об этом, не сослался на Жерара, указавшего на его ошибку. В связи с этим Жерар пишет: «Когда мы выскаэываем какое-либо мнение, идею, которая затрагивает общепршштые догмы, которая направлена против рутины, то поднимают большой крик и применяют против нас самые резкие слова. Но потом, когда оказывается, что мы, правы, присуждают честь другим. Всегда повторяется то же: вначале считают это абсурдом, а когда правда наконец всплывает на поверхность, тогда говорят, что мы это давно знали» [1, стр. 381].
Самым слабым местом в теории Берцелиуса являлась гипотетичность радикалов и невозможность выделить их в свободном виде. Поэтому вполне понятным было стремление защитников устаревшей теории радикалов во что бы то ни стало Доказать существование сложных радикалов в свободном виде. Кольбе и Франкланд, действуя металлическим калием на цианистый метил и цинком на йодистый этил, получил два соединения (1848—1849), которые приняли за свободные радикалы — «метил» (СН3) и «этил» (C2H5). Жерар предложил удвоить эти формулы, чтобы привести эти соединения к двум объемам. Кроме того, он заметил, что эти соединения являются гомологами метана CH4; Франкланд позже согласился с мнением Жерара, считая свой метил водородистым этилом C2H5H. Гофман, сравнив физические константы обоих соединений, тоже присоединился к мнению Жерара. «Если, между прочим, опыт подтвердит мнение Лорана и Жерара, — писал он, — если эти тела действительно являются гомологами болотного газа, это обстоятельство еще больше увеличит интерес к ним» [1, стр. 377]. Жерар был очень доволен, что Гофман, зять Либиха, химик Гиссенской школы, примкнул к нему.
Жерар предвидел существование «смешанных радикалов», т. е. углеводородов, которые можно рассматривать как соединения более низших радикалов. «Так же, как существует этилметиловый эфир, яадо допустить, что можно будет получить смешанные радикалы: этилметил, амилметил» [1, стр. 378]. В 1853 г. Вюрц с помощью разработанного им синтеза углеводородов (действуя натрием на галогеналкилы) получил «смешанные радикалы». Это открытие не только опровергло теорию радикалов, но я послужило убедительным подтверждением унитарной системы Жерара, ее объемной основы, ее правила четности. Вюрц химическим путем доказал, что существуют органические соединения, аналогичные H2, т. е. состоящие из двух одинаковых или разных радикалов.

Шарль Шансель
Для утверждения и развития идей Жерара немалое значение имел синтез аминов. В 1842 г. Зинин создал удобный и доступный способ получения анилина действием сернистого аммония на нитробензол. Через пять лет Вюрц получил метиламин и этиламин и высказал несколько гипотез о их строении; одна из них заключалась в том, что амины можно рассматривать как продукты замещения водорода в аммиаке соответствующими спиртовыми радикалами [41]. Гофман, установив, что анилин аналогичен эминам Вюрца, получил этиланилин и ди-этиланилин, я это привело его к мысли о существовании вторичных и третичных аминов [42].
Действуя аммиаком на бромистый этил, Гофман получил три амина, отличающихся друг от друга числом атомов водорода, замещенных этилом. Отсюда он счел, что аммиак можгао рассматривать как «тип» аминов, а сами амины — как продукты замещения водорода в аммиаке. Схематически Гофман изобразил это следующим образом:
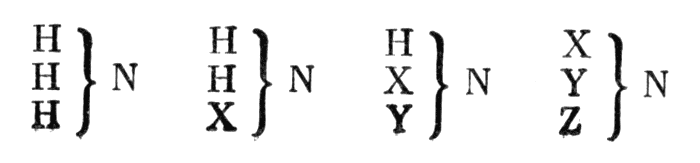
Схематически Гофман изобразил это следующим образом
Ему удалось также получить амины-метамеры с разными спиртовыми радикалами.
Все эти синтезы подтвердили правильность формулы аммиака, предложенной Жераром (NH3 вместо N2H6), его правила четности и правила остатков, а также существование нового гомологического класса. Жерар писал: «Читая о замечательных опытах Гофмана с этиланилином, диэтиланилином, каждый узнает остатки, т. е. радикалы унитарной системы. Этил — такой же остаток, как и нитрозный пар (NO2) в нитрованных телах» [1, стр. 378].
В 1850 г. была опубликована работа Вильямсона об образовании эфира [43]. Вильямсон получил этиловый эфир из этилата калия и йодистого этила. Эту реакцию он объяснил с помощью унитарных идей Жерара и Лорана, а также предположения Лорана, что спирт и эфир (как едкое кали и окись калия) являются продуктами замещения атомов водорода в типе воды (ННО, КНО, ККО, EtHO, EtEtO). Реакцию образования этилового эфира Вильямсон записал следующим образом:
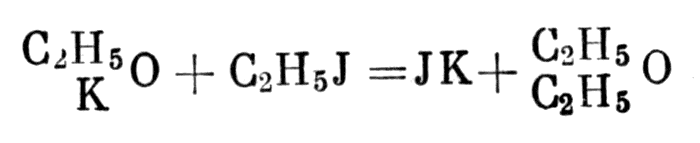
Реакцию образования этилового эфира Вильямсон записал следующим образом
Вильямсон получил также простые смешанные эфиры
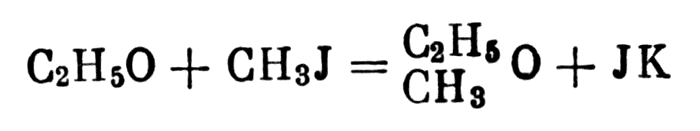
Вильямсон получил также простые смешанные эфиры
Опыты Вильямсона опровергли выводы теории радикалов о составе спирта и эфира, так как согласно этой теории при взаимодействии этилата калия и йодистого этила должны были бы получиться два разных эфира.
С4Н10О•КО + C2H6J = С4Н10O + С2Н6О + JK
(К = 78; J = 254)
Жерар с восторгом воспринял результаты опытов Вильямсона. «Люди, наиболее предубежденные против новым идей, вынуждены сегодня сдаться; они должны, как это так хорошо доказывает Вильямсон, или удвоить формулы эфира, воды и другие употребляемые формулы, или раздвоить формулу спирта и большинства органических веществ <...> Восемь лет назад я впервые обратил внимание на это противоречние в системе наших формул, но большинство химиков во главе с Берцелиусом видели в моем обозначении странную фантазию, смешное новшество, которое даже не стоит обсуждать. Сегодня мои противники, возможно, будут более человечными» [1, стр. 384]. Жерар напоминает, что еще в 1842 г. он предложил двух-объемные формулы спирта (С2Н6O) и эфира (С4Н10О), и опыты Вильямсона подтверждают мысль Жерара о том, что все молекулярные формулы имеют два объема. Шансель почти одновременно с Вильямсоном опубликовал статью, сообщающую о получении сложных смешанных эфиров (эфиры угольной и щавелевой кислот); этим он подтвердил мнение Жерара о двухосновности данных кислот.

Фотокопия начала письма Жерара Шанселю
Вильямсон, продолжая исследования в этой области, в статье [44] 1851 г. указывает, что уксусную кислоту можно рассматривать как продукт замещения одного атома водорода в воде группой С2Н3О. Отсюда, по аналогии с эфиром, он приходит к мысли о существовании ангидрида уксусной кислоты
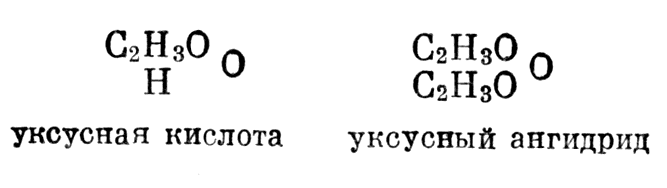
Отсюда, по аналогии с эфиром, он приходит к мысли о существовании ангидрида уксусной кислоты
Почти одновременно со статьей Вильямсона Жерар опубликовал большую теоретическую работу о строении органических соединений [45], выполненную жц вместе с Шанселем. В этой работе авторы подробно останавливаются на проблеме химических формул, на их смысле и значении, обсуждают научную классификацию органических соединений, но главное, что здесь мы находим первый набросок теории типов Жерара. Он предсказывает возможность существования «смешанных радикалов» и изомеров углеводородов. В этой же статье он признает, что и одноосновные кислоты могут давать ангидриды. В следующей статье Жерар поднимает вопрос о критериях основности кислот и приходит к выводам, совпадающим с современными. Исходя из опытов Девиля, получившего азотный ангидрид (1849), он уже признает, что и одноосновные кислоты дают ангидриды. Но в противоположность сторонникам теории радикалов, приписывающим азотной кислоте формулу NO5•НО (O = 8), а ангидриду NO5, предполагая, что NO5 предсуществует в кислоте, Жерар доказывает, что формула азотного ангидрида N2O5 и он образуется из двух молекул азотной кислоты путем отнятия молекулы воды: 2NO3H — Н2O = N2O5 [1, стр. 398]. В конце 1851 г. Жерар начинает исследования, которые привели его к открытию ангидридов одноосновных органических кислот — бензойной, уксусной, масляной, коричной, куминовой кислот, смешанных ангидридов и хлорангидридов этих кислот. В апреле 1852 г. Жерар закончил эти исследования и сообщил о них Шанселю. В частности, он пишет:
«Париж 5 апреля 1852
Мой дорогой друг!
Так как формула азотной кислоты
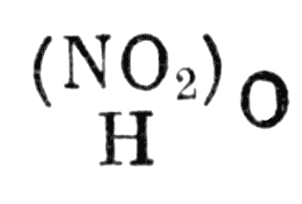
Формула азотной кислоты
а безводной азотной кислоты должна быть
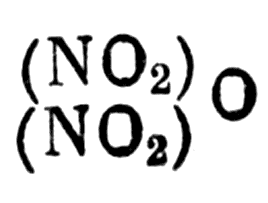
Формула безводной азотной кислоты
следовательно, бензойная кислота будет
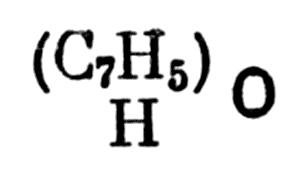
Бензойная кислота
Итак, надо открыть
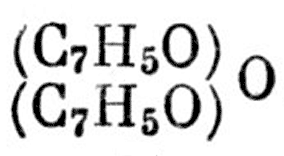
Это тело (вещество, — М. Ф.) приготовлено
Это тело (вещество, — М. Ф.) приготовлено. Наконец, надо получить
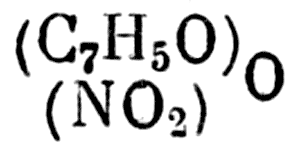
Нейтральное тело
— нейтральное тело, которое не было бы бензойной кислотой. А ведь оно тоже получено.
Также следует получить
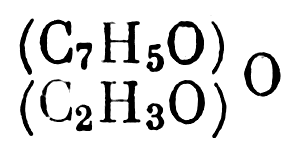
Также следует получить
и т. д. и т. д.
И многое другое получено Вашим покорным слугой» [1, стр. 403].
Эти работы Жерара подтвердили мысль Вильямсона о том, что спирты, эфиры, кислоты и их ангидриды являются производными типа воды, а также взгляды Жерара о радикалах как об остатках, замещающих определенное число атомов водорода. Получила подтверждение и формула молекулы воды Н2О, которую сторонники эквивалентов писали НО, а Берцелиус НО, считая, что в соединениях всегда участвует сдвоенный атом водорода (Н2 или Н).
В заключение следует отметить тот факт, что открытия, подтвердившие унитарную систему, показавшие, что на ее основе возможно предугадывать еще не открытые соединения, были сделаны главным образом не самим Жераром, а другими учеными. Среди них были и сторонники теории радикалов (Франкланд, Кольбе, Гофман), и это имело большое значение для признания и распространения новых идей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'