
Способы стабилизации растворов
На основе таких теоретических соображений и накопленного практикой опыта применяют следующие способы стабилизации растворов химической металлизации.
Во-первых, уменьшают концентрации реагирующих ионов металла и особенно восстановителя, а также температуру. Но при этом снижается и скорость, а также затрудняется инициирование процесса металлизации.
Во-вторых, увеличивают концентрации лигандов или используют такие лиганды, с которыми ионы металла образуют более прочные комплексы, что значительно стабилизирует растворы. В некоторых случаях это соответствует простому уменьшению концентрации свободных ионов металла, т. е. вполне согласуется с термодинамическими представлениями, но чаще всего влияние природы лигандов на стабильность растворов и скорость металлизации так просто объяснить не удается.
В-третьих, раствор химической металлизации следует охранять от загрязнений пылью, частицами металлов, катализатором из раствора активатора и другими веществами, которые могут инициировать реакцию химической металлизации. То есть следует придерживаться как бы тех же самых противопожарных правил поведения, к которым мы привыкли, живя рядом с горючими веществами в кислородсодержащей атмосфере. Более того, поведение растворов химической металлизации напоминает поведение горючих веществ и тем, что чем более горюче вещество, тем быстрее оно воспламеняется; так и растворы химической металлизации: чем с большей скоростью они металлизируют, тем быстрее разлагаются. Погружение в раствор пластмассовых деталей, имеющих большую активированную поверхность, может вызвать бурную реакцию восстановления металла и привести к полному разложению раствора. (Обычно стараются поддерживать отношение величины покрываемой поверхности к объему раствора металлизации в пределах нескольких квадратных дециметров на 1 л.) Вполне может быть, что при этом некоторые активные промежуточные продукты отрываются от поверхности и, переходя в объем, рождают в нем частицы металла. Известно, что если раствор химического никелирования обтекает покрываемую поверхность с большой скоростью, то процесс никелирования на такой поверхности не идет. По-видимому, что-то нужное для реакции уносится и она гаснет, как пламя, задутое ветром.
Для удаления образующихся со временем в объеме раствора частиц металла растворы химической металлизации рекомендуется непрерывно фильтровать. Фильтрацией иногда удается остановить начавшееся разложение раствора. Лучшими для этой цели являются микропористые фильтры с диаметром отверстий 1-20 мкм.
И наконец, в растворы химической металлизации вводят стабилизаторы, которые препятствуют объемной реакции восстановления ионов металла. Идеальный стабилизатор полностью прекращает взаимодействие восстановителя с ионами металла в растворе и не уменьшает скорости образования металлического покрытия.
В качестве стабилизаторов используют самые различные химические соединения. Это и окислители (кислород, перекись водорода), и ионы металлов-ингибиторов (ванадия, висмута, молибдена, ниобия, рения, мышьяка, сурьмы), и соли серы, селена, таллия, ртути, и органические соединения серы, азота, фосфора, и поверхностно-активные вещества. Однако хороших стабилизаторов еще очень мало, так как многие из применяемых в настоящее время, будучи каталитическими ядами, сильно замедляют скорость металлизации. Исходя из этих соображений полезность действия стабилизаторов можно выразить следующим соотношением: An=ντi/ντo*τio-1, где ν и τi - соответственно средняя скорость осаждения металла и продолжительность стабильной работы раствора (индукционный период разложения) в присутствии стабилизатора, а νo и τio - то же, но без стабилизатора. При An=0 добавка предполагаемого стабилизатора не оказывает ни положительного, ни отрицательного влияния, а при -1<An<0 - ухудшает эффективность использования раствора химической металлизации. При An>0 стабилизатор явно полезен, и чем большее значение An, тем больше полезность стабилизатора, тем ближе он к идеальному.
Следует отметить, что от стабилизатора зависит и такое своеобразное свойство растворов химического меднения, как дифференциальный рост покрытий. В отверстиях или узких щелях покрытие растет быстрее, чем на плоской поверхности, и при определенной толщине его рост прекращается*. Это явление в последнее время привлекает все большее внимание из-за возможности создания на его основе высокоэффективных технологий металлизации печатных плат.
* (Подрядчик Р. С., Шалкаускас М. И. Опыт толстослойного химического меднения. - Обмен опытом в радиопромышленности, т. 14, 1973, № 1, с. 18-21; Poskanzer А.М., Davis S.С. An efficient electroless plating system for printied circuitry. - Plating and Surface Finishing, 1982, vоl. 69, N 5, pp. 94-97.)
Причины автокатализа и механизм процессов химического осаждения (восстановления) металла тоже еще полностью не раскрыты. Существует довольно много различных предположений, среди которых можно выделить два направления.
Первое из них опирается на ставшие фундаментальными представления французского химика П. Сабатье о решающей роли промежуточных соединений в процессах катализа. Согласно этому подходу, процессы автокаталитического восстановления металлов протекают на поверхности металла потому, что только на ней из восстановителя отщепляется активный промежуточный продукт, вероятнее всего, соединение водорода, которое и восстанавливает ионы металла. Полагают, что такими соединениями могут быть: водород в адсорбированном состоянии, ионы гидрида, прямо связанные с металлом, более сложные соединения гидридного типа с ионами металла. Можно предположить, что гидриды или соединения гидридного типа окисляются только до водорода. Тогда хорошо объясняется тот факт, что при окислении восстановителя на поверхности металла выделяется водород. В некоторых случаях водород образуется в таком же количестве, как и восстановленный металл, то есть на 1 моль восстановленного металла выделяется 1 моль водорода. Таким образом, восстановление ионов металла можно выразить уравнением
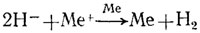
Прямых доказательств участия ионов гидрида в процессах химической металлизации пока нет. Установлено лишь, что при восстановлении ионов меди борогидридом процесс протекает через промежуточное образование гидрида меди (CuH), который в щелочной среде раствора меднения разлагается на медь и водород. Однако утверждать, что это. имеет место во всех случаях, было бы слишком смело.
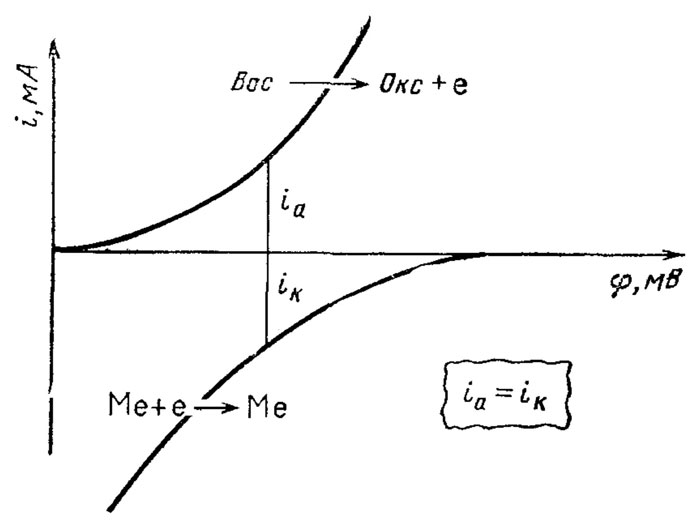
Рис. 7. Сопряжение электрохимических реакций анодного окисления восстановителя (Вос. ⟶ Окс. + е) и катодного осаждения металла (Ме+ + e ⟶ Ме0) в процессе химической металлизации в растворах
Другое направление исходит из того очевидного положения, что в электролите на металлическом электроде всегда протекают электрохимические реакции. Следовательно, при анодном окислении восстановителя потенциал электрода сдвигается в отрицательную область, где должны протекать и катодные процессы электрохимического осаждения металла из его ионов. Таким образом, весь окислительно-восстановительный процесс химической металлизации протекает на металлической поверхности электрода путем сопряжения двух или более электрохимических реакций (рис. 7). Подобные же рассуждения приводят при объяснении процессов коррозии металлов, только при коррозии процесс идет в направлении растворения металла, а при химической металлизации - в направлении его осаждения.
Движущей силой такого электрохимического процесса является необратимое каталитическое электрохимическое окисление восстановителя (анодный процесс), что создает достаточно отрицательный потенциал для обратимого электрохимического восстановления ионов металла (катодный процесс). Скорость всего процесса часто определяется скоростью реакции, протекающей на аноде.
Все это относится к сравнительно молодой отрасли химии, занимающейся изучением явлений электрокатализа - ускорения электродных реакций под влиянием природы материала электрода. Теория электрокатализа не исключает возможности участия в процессе химического осаждения металлов и промежуточных продуктов - водорода, гидридов или соединений гидридного типа. Такой подход дает возможность изучать в отдельности электрохимическое окисление восстановителя и электрохимическое осаждение металлов, а также использовать богатейший материал, накопленный гальванотехникой за последние 100 лет. Для контроля и управления процессами химической металлизацией в растворах можно использовать электрохимические методы измерения потенциала металлизируемой поверхности металла или электрического тока сопряженных электрохимических реакций.
Конечно, и второй подход не раскрывает детального механизма процессов химической металлизации. Некоторые из них, такие, как меднение, никелирование, кобальтирование, серебрение и золочение, удалось объяснить участием электрохимических реакций, но в других случаях, исходя только из электрохимических соображений, этого сделать не удается. Имеются случаи, когда, например, катодный процесс электроосаждения металла значительно ускоряется небольшими добавками восстановителя, которые, казалось бы, не должны вообще как-то влиять на электровосстановление металла. И наоборот, небольшие добавки ионов металла ускоряют анодное окисление восстановителя, проявляя каталитические свойства. Все это указывает, что наряду с электрохимическими реакциями протекают и чисто химические с непосредственным переносом электрона от восстановителя к окислителю (иону металла) и с образованием промежуточных продуктов, оказывающих значительное влияние на электрохимические реакции. Так что при изучении процессов химической металлизации нужно иметь в виду обе возможности (рис. 8). Кроме того, возможен и внутрикомплексный перенес электрона в комплексном соединении иона металла с восстановителем при адсорбции его на поверхности металла. Существование таких комплексных соединений установлено. Однако еще нет прямых доказательств, что каталитический процесс восстановления ионов металла протекает при участии именно этих координированных в комплексное соединение молекул восстановителя. Но при восстановлении ионов металла в объеме раствора это наиболее вероятный путь. В ходе внутрикомплексного восстановления образуются кластеры (многоядерные комплексы), состоящие из нескольких атомов металла, к которым в дальнейшем последовательно присоединяются новые атомы металла. Такой процесс продолжается до тех пор, пока не образуется частица металла, на которой уже может идти автокаталитическая реакция.
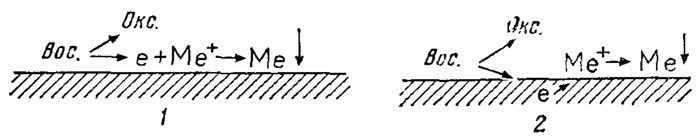
Рис. 8. Схематическое изображение химического (1) и электрохимического (2) процессов реакций окисления-восстановления в процессе химической металлизации в растворах
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'