
Глава V. "Нечто невидимое" и опыты с ним
Один знаменитый астроном назвал гигантские хвосты комет, перед которыми весь наш земной шар кажется чуть ли не песчинкой, "видимое нечто": так ничтожна масса этих хвостов в сравнении с их размерами.
Наоборот, все бесцветные газы могут быть названы "нечто невидимое", так как мы, хотя и не воспринимаем их зрением, но легко можем обнаружить их материальную природу.
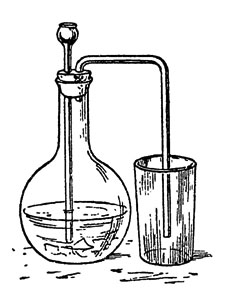
Рис. 30. Добывание углекислого газа
Чтобы добыть одно из таких "нечто невидимых", в количестве, достаточном для опытов, я в колбу с газоотводной трубкой бросаю кусочки мела, обливаю их слабой соляной кислотой и через газоотводную трубку (рис. 30) отвожу выделяющийся углекислый газ в открытый сосуд совершенно так же, как если бы наполнял его через трубку водою.
Углекислый газ почти в полтора раза тяжелее воздуха, в малых количествах не вызывает затруднения дыхания, а потому и допускает такое упрощенное собирание. Он вливается в сборный сосуд, как вливался в него хлор, и не беда, если и перельется через край, чего о хлоре сказать нельзя.
"Таинственный" опыт с весами
Приверженцы тайных знаний, оккультисты, утверждали, будто человек силою воли может нарушать законы тяготения, будто, помещая руку ладонью вниз над чашкой весов, он, по желанию, заставляет ее подниматься вверх и опускаться вниз. Это, конечно, чушь, а вот я действительно могу, не прикасаясь к весам и как-будто ничего не добавляя на одну из чашек, заставить ее опуститься вниз.
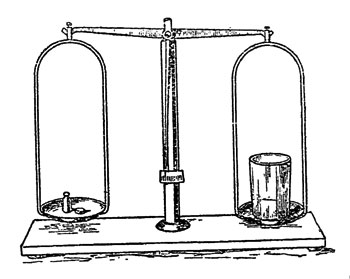
Рис. 31. 'Таинственный' опыт с весами
Только тут нет никакого "волшебства". Просто я взвешиваю "нечто", хотя и невидимое, но вполне материальное и, следовательно, как и всякая материя, имеющее вес. Перед нами простые, но довольно чувствительные весы (их можно заменить весами для писем) и пустой стакан, поставленный на одной чашке и уравновешенный гирями на другой. "Налив" в другой стакан угольного ангидрида из прибора, в котором он у меня получается, переливаю газ в стакан, подвешенный на весах. Коромысло весов склоняется, стакан опускается вниз (рис. 31), продолжая, по-видимому, оставаться пустым. Он, конечно, не пуст, да и раньше не был пустым. Сначала он был полон воздухом, а теперь наполнился угольным ангидридом. Последний более тяжел, оттого и нарушилось равновесие весов.
Природа - архитектор
Мы видели, что углекислая известь растворяется в кислотах. Добавляю, что даже в такой слабой, как угольная.
Опускаю газоотводную трубку от аппарата, в котором получается углекислый газ, в сосуд с известковой водой, - раствор мутнеет. Продолжаю дальше и дальше пропускать через него газ. Смотрите. Постепенно муть исчезает, и вот жидкость снова стала прозрачной.
Угольный ангидрид сначала связал всю растворенную известь в нерастворимую углекислую, а эта последняя с избытком угольного газа образовала двууглекислую известь, вновь перешедшую в раствор. Переливаю этот раствор в колбочку и нагреваю. Замечаете выделение пузырьков газа и вторичное помутнение жидкости?
Производя этот любопытный опыт, мы в малом масштабе воспроизвели одно из великих явлений природы. Воды подземных источников, насыщенные углекислотою, проходя по известковым породам, выщелачивают их и несут в растворе двууглекислую известь. Выходя на поверхность или просачиваясь в пещеры, они теряют углекислоту, выделяя углекислую известь в виде пористого туфа или натеков причудливых форм, строя подземные дворцы и пещеры.
Не менее важен этот процесс и для техники.
Всем нам знакома накипь внутри самоваров, образуемая жесткой, то-есть содержащей в растворе известковые соли, водой. Такая же накипь образуется в паровых котлах. Так как ее теплопроводность значительно меньше, чем металлических стенок котла, то и расход топлива в котле, имеющем накипь, больше, чем в чистом. Но такое загрязнение котла не только снижает полезную работу котла и машин, - оно крайне опасно. Нагревшись, накипь дает трещины; вода, коснувшись раскаленных стенок котла, мгновенно обращается в пар высокого давления и разрывает котел на части.
Взрыв паровых котлов - явление, увы, далеко не редкое и часто влечет за собою немало человеческих жертв.
Величайшим из взрывов, известных в истории техники, был одновременный взрыв двадцати двух соединенных между собою паровых котлов в ночь на 25 июля 1887 г.
Мне случайно пришлось видеть последствия этого взрыва. Он произошел в Фриденсхютте, в Силезии.
Сила взрыва была ужасна. Достаточно сказать, что камни котельного помещения, куски котлов и части трупов погибших при взрыве людей были разбросаны по радиусу около полутора километров...
Одним из способов для устранения накипи является предварительная очистка и подогревание воды, питающей паровой котел, и другие меры. К сожалению, они устраняют не все "накипеобразователи". Универсального средства для предупреждения образования накипи мы пока не имеем.
Плавающие пузыри
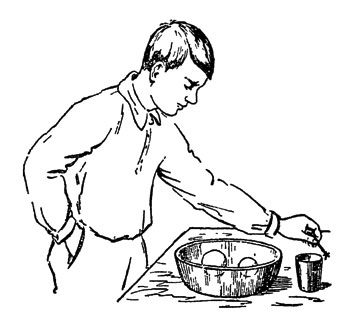
Рис. 32. Плавающие пузыри
Наполните какую-нибудь миску или невысокий и широкий стеклянный сосуд до половины углекислым газом и займитесь выдуванием мыльных пузырей. Стряхивайте их осторожно с соломинки на поверхность тяжелого газа (рис. 32). Они будут им поддерживаться, не опускаясь на дно сосуда. Для постороннего зрителя, не знающего, в чем дело, такое висение мыльного пузыря в "воздухе" кажется совершенно непонятным. Еще менее понятным кажется тот факт, что пузырь, сброшенный вами с большой высоты в миску, упав в нее, подпрыгнет вверх. Вы-то, впрочем, знаете, в чем дело: это он отталкивается от поверхности углекислого газа, как мяч отталкивается вверх, упав на пол. Однако, быть может, и вас, а тем более ваших товарищей, смотрящих на ваши опыты, изумит постепенное увеличение пузыря, висящего в сосуде. Если пузырь "долговечен" и в течение двух-трех минут не лопнет, то он раздуется и погрузится на дно сосуда. Происходит это от проникновения (диффузии) сквозь его оболочку угольного газа. Газ увеличивает объем мыльного пузыря, но одновременно делает шар более тяжёлым.
Отчего стреляет пушка
В толстостенную бутылку до половины наливаю тепловатой воды. Отдельно заворачиваю в пропускную бумагу столовую ложку двууглекислой соды и столько же виннокаменной кислоты. Бросаю пакетики в бутылку и быстро закупориваю ее заранее подобранной плотно входящей в ее горло пробкой. Встряхиваю бутылку.
Бах! Пробка летит в потолок, пенящаяся жидкость вылетает из горла бутылки.
Опыт, как видите, весьма несложен, а выводов из него можно сделать на целую страницу.
Во-первых, двууглекислая сода отличается от обыкновенной (углекислого натрия) большим содержанием угольного ангидрида. Такие соли носят название кислых.
Во-вторых, вытесняемая из соли виннокаменной кислотой углекислота не растворяется в теплой воде, а бурно выделяется и выбивает пробку. Именно поэтому "убегают" квас и другие шипучие напитки, если их откупоривают недостаточно холодными, рвут пробку в потолок, а иногда, находясь в теплом месте, разрывают и самые бутылки.
В-третьих, угольный ангидрид активизирует деятельность органов пищеварения, почему и пьют естественные "минеральные" воды, богатые угольным газом, и готовят искусственные шипучие напитки. В последних угольный газ либо развивается в результате естественного химического процесса - брожения*, как это имеет место в квасе, пиве и вине; либо выделяется, как в нашем случае, при взаимодействии двууглекислого натрия с виннокаменной или лимонной кислотами, безвредными для здоровья; либо, наконец, вводится в них извне под давлением.
* (Брожение - результат жизнедеятельности различных микроорганизмов, меняющих химический состав обитаемой ими питательной среды. Бактерии спиртового брожения разлагают сахарные вещества с выделением алкоголя, угольного газа и малых доз других соединений. Таким путем виноградный сок бродит, превращаясь в вино. Так же происходит и подъем теста дрожжами от выделяемой углекислоты. Действуют не сами живые организмы, а химические соединения (энзимы), ими выделяемые.)
А в-четвертых, пробка вылетает из бутылки потому, что из твердых соединений, занимавших небольшой объем, сразу выделилось большое количество газа.
При взрыве пороха это внезапное увеличение объема при переходе из твердого состояния в газообразное происходит еще быстрее и еще значительнее. Оттого-то пороховые газы, стремясь расшириться, и выталкивают тяжелый артиллерийский снаряд с такой начальной скоростью, что он летит на десятки верст.
Очистить яйцо, не разбив скорлупы
У французов есть поговорка: "Нельзя приготовить яичницу, не разбив яиц". Химику, услышав эту пословицу, остается только пожать плечами. Нет ничего легче и проще, как очистить яйцо, не разбивая его скорлупы.
Хотел бы думать, что вы уже догадались, как это сделать, если знаете, что твердая оболочка яйца - тоже углекислая известь, как мел и мрамор.
Стоит только опустить яйцо в слабый раствор соляной кислоты. Конечно, после растворения скорлупы - есть яйцо без хорошего промывания нельзя.
При этом вы попутно сможете показать желающим еще такой фокус:
Ныряющее яйцо
Удельный вес сырого яйца немногим больше удельного веса слабой соляной кислоты. Опустившись на дно сосуда, яйцо покрывается пузырьками угольного ангидрида и всплывает на поверхность. На поверхности жидкости пузырьки газа оторвутся от скорлупы яйца и улетят в воздух, а яйцо вновь опустится.
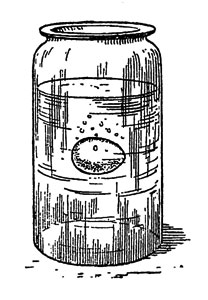
Рис. 33. Ныряющее яйцо
Такое ныряние и всплывание яйца (рис. 33) будет происходить до тех пор, пока вся скорлупа не растворится.
Можете теперь вынуть яйцо, сполоснуть его водой и выпустить на сковородку, но можете проделать с ним еще один из следующих двух опытов.
Растущее яйцо
Тоненькая пленка, облегающая яйцо, останется неразрушенной действием кислоты, растворившей скорлупу. Эта пленка пропускает кристаллические вещества (кристаллоиды) и задерживает так называемые коллоиды*, к каковым относится яичный белок, не способный кристаллизоваться. Явление это называется диализом и используется в технике для отделения от коллоидных растворов нужных веществ.
* (От греческого слова Κολλα - клей.)
Поэтому яйцо, положенное в чистую, несколько раз в сутки сменяемую воду, вскоре освобождается от следов соляной кислоты, проникшей через оболочку, и начинает впитывать в себя воду, не давая в то же время своему содержимому проникать наружу.
"Но позвольте, - спросите вы, - да разве вода - кристаллоид?"
Вспомните красивые кристаллы льда на наших окнах в зимнее время, рассмотрите внимательно иглы инея, покрывающего ветви деревьев зимою, и, наконец, вглядитесь в правильную форму мелких снежинок. Если вы задали такой вопрос, - вам станет неловко.
Через трое суток лежания в воде яйцо, освобожденное от скорлупы, заметно увеличится в объеме. Вот способ делать крупные яйца из мелких.
Яйцо в графине
Но если вам покажется скучным трое суток ждать результатов предшествующего опыта, сделайте вместо него с тем же яйцом другой опыт.
Предложите кому-либо ввести в бутылку с широким горлом или в графин яйцо.
Задача эта старая, и решалась она всегда чисто физическим путем. Вкрутую сваренное яйцо, освобожденное от скорлупы, советуют положить острым концом в горло графина, из которого часть воздуха предварительно удалена нагреванием. Для этого достаточно сжечь в графине кусок бумаги. Воздух при этом расширяется, и часть его выходит наружу. Яйцо по мере охлаждения графина вталкивается внутрь последнего давлением наружного воздуха. В момент, когда оно падает на дно графина, слышится звук как бы выстрела. Это вслед за яйцом врывается в графин наружный воздух (рис. 34).
Рис. 34. Яйцо, вталкиваемое в сосуд атмосферным давлением
Еще эффектнее провести весь опыт чисто химическим путем. Ничего жечь внутри графина (с риском, что он еще, чего доброго, лопнет) не надо, а надо его наполнить угольным ангидридом и, держа в одной руке яйцо, другой быстро вылить в графин из пробирки крепкий раствор едкого кали (беречься брызг!) и в тот же момент закупорить отверстие графина яйцом.
Едкий кали поглощает угольный ангидрид, превращаясь в углекислый калий (поташ), так что в графине образуется разреженное пространство, и яйцо "всасывается" в графин.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'