
Глава VIII. Кое-что о кристаллах
Характерной особенностью большинства известных нам простых и сложных веществ является их способность при определенных условиях приобретать строго правильную форму - образовывать кристаллы.
Поваренная соль, сахар, вода ниже точки ее замерзания, многие минералы, драгоценные камни и даже металлы дают кристаллические формы.
Кристаллы образуются: в момент образования вещества в результате химической реакции, при присоединении к молекуле некоторых солей одной или нескольких молекул воды, при осаждении растворенного вещества из раствора, при переходе из газообразного или жидкого состояния вещества в твердое.
В природе геометрически правильные кристаллы образуются редко, обыкновенно они искажены или недоразвиты, а развиваясь в тесном соседстве друг с другом, срастаются и теснят друг друга, образуя кристаллические агрегаты.
Искусственное получение правильно образованных кристаллов дает наилучшие результаты при осаждении их из водных растворов.
Оно же дает возможность познакомиться с замечательной способностью кристаллов восстанавливать нарушенную правильную форму. Вы, может быть, знаете, что холоднокровные животные обладают такой способностью. У ящерицы отрастает отломанный хвост, а у тритона даже лапка. Только эти новые органы получаются недоразвитыми и уродливыми. Кристаллы чинят себя лучше.
Возьмите какие-нибудь квасцы. Квасцы - это двойная сернокислая соль щелочного металла (или аммония) и алюминия, железа или хрома.
В продаже они встречаются в виде более или менее крупных, но неправильных, сломанных и сросшихся друг с другом кристаллов. Истолките их в фарфоровой ступке и растворите в горячей воде. По мере отстаивания раствора, на дно сосуда выпадут кристаллики квасцов, которые будут расти, увеличиваясь, как растут организмы, в весе и объеме.
Бросьте в такой раствор крупный кристалл тех же квасцов с отбитым углом или поврежденной гранью. Вы увидите, как он постепенно залечит поранение и приобретет геометрически правильную форму.
Но и ваши кристаллы, вырастающие на дне сосуда, еще не будут нормально развитыми: грань, на которой они лежат, останется недоразвившейся. Для получения правильно образованного кристаллика опустите в теплый раствор нитку гаруса. На ее волоконцах при остывании раствора образуются геометрически правильные кристаллики. Отберите 2-3 из них покрупнее, они понадобятся нам для опыта медленной кристаллизации.
Цветной раствор бесцветного вещества
Позвольте предложить вам вопрос:
- Какого цвета будет раствор бесцветного вещества в совершенно частой воде?
Вы вспоминаете о растворах сахара, поваренной соли, селитры, нашатыря и других бесцветных соединений и отвечаете:
- Если в воде не растворено заранее какое-нибудь другое бесцветное вещество, дающее с первым цветное соединение, то раствор должен быть бесцветным.
Так ли это? Проверим.
Во избежание "обмана" с моей стороны, налейте сами в пробирку или в стакан воды из водопроводного крана.
Всыпаю в нее вот этот белый порошок. Вода принимает красивую темно-голубую окраску.
Перельем ее в фарфоровую чашку и выпарим.
Посмотрите, что у нас осталось на дне чашки. Кристаллики прекрасного синего цвета. Это медный купорос, с которым нам приходилось и раньше встречаться.
Жаль, что мы перед тем, как растворить наш белый порошок, не взвесили его. Это можно было бы сделать на весах для писем. Взвесив после того полученные синие кристаллики, мы бы убедились, что они весят больше, чем весил порошок. Значит, к растворенному порошку (это был порошок безводной сернокислой меди) что-то присоединилось химически, так как и вес увеличился, и свойства вещества изменились. Это "что-то" не может быть ничем другим, кроме воды, потому что мы растворяли порошок в чистой воде.
Легко доказать, что так оно и есть. Истолчем полученные синие кристаллы в голубой порошок и станем их сильно нагревать в фарфоровой чашке: голубой порошок превратится в белый, вес его уменьшится, а на холодной тарелке, которую мы будем держать над чашкой, осядут капли воды.
Перемена розовой окраски солей кобальта на голубую, зеленой соли никкеля на желтую и т. д. зависит от той же причины. Будучи безводными, они имеют не тот цвет, который приобретают, образовав кристаллические соединения с водой.
Не думайте, однако, что кристаллы всех веществ содержат в своем составе воду. Большинство их кристаллизуется без ее участия, как и сама вода, образуя кристаллы снега, ни с чем не соединяется.
Медленная кристаллизация
У вас должны были сохраниться правильно развитые кристаллики каких-нибудь квасцов. Заготовьте горячий раствор таких же самых квасцов, - скажем, калиево-алюминиевых, и подвесьте внутри его на тонкой нити один из ваших кристалликов. Верхний конец нити укрепите на стеклянной палочке, положенной на края широкогорлого сосуда с раствором.
Прикрыв сосуд листком бумаги от пыли, оставьте его дня на два в теплом месте, чтобы раствор остывал возможно медленнее. Пополняйте в дальнейшем воду, по мере ее испарения, и поддерживайте начальную концентрацию раствора приливанием крелкого раствора тех же квасцов.
Кристалл будет расти все больше и больше.
Опыт неэффектный и займет у вас очень много времени, так... примерно, до полугода. Но растим же мы годами цветы, птиц и животных, - почему бы не затратить нескольких месяцев на выращивание кристалла размером по его продольной оси хотя бы сантиметров в 5-6?
А чтобы конечный результат неэффектного опыта оказался эффектным и чтобы несколько разнообразить работу над выращиванием кристалла-великана, воспользуйтесь свойством близких по химическому составу веществ давать кристаллы одинаковой геометрической формы и изготовьте не просто крупный кристалл, хотя бы калиево-алюминиевых квасцов, а еще и сложный.
Когда этот белый кристалл достигнет, скажем, размера, равного по продольной оси одному сантиметру, опустите его осторожно в раствор зеленых железных квасцов. Вы увидите, что ваш белый кристалл в таком растворе постепенно покроется слоем зеленых железных квасцов. Когда размер кристалла увеличится до двух сантиметров, перенесите его в темно-фиолетовые хромовые квасцы и т. д. в любом порядке и столько раз, насколько хватит терпения. Распилив лобзиком полученный сложный кристалл, можете удивить им товарищей. В нем белый, зеленый и темно-фиолетовый слои будут сменять друг друга.
Мгновенная кристаллизация
Вы знаете, что вещества, способные кристаллизоваться, выделяются из растворов в течение более или менее продолжительного времени. Чем слабее раствор, чем медленнее он охлаждается, тем медленнее растут кристаллы растворенного в нем вещества, и тем крупнее они получаются. Но можно и в один момент превратить раствор кристаллического вещества целиком в твердое тело. При этом вода, в которой оно было растворено, химически соединяется с ним: жидкость мгновенно затвердевает.
Опыт эффектный, но требующий большой аккуратности.
Лучше всего он идет с уксуснонатриевой солью. Измельчив ее в порошок, растворяют в кипящей воде до насыщения, присыпая порошок до тех пор, пока ни взбалтывание колбы, ни размешивание осадка стеклянной палочкой не будут больше способствовать растворению излишка соли. Насыщенный раствор сливают с осадка в другую меньшую колбу, заполняя ее до самого верха и плотно закупоривая пробкой. Охладившись, раствор не выделяет кристаллов и является уже не только насыщенным, а пересыщенным, - пересыщенным потому, что в данном объеме воды комнатной температуры нельзя растворить столько соли, сколько содержится в нем.
Раствор можете взбалтывать, можете бросить в него кристаллик какой-нибудь другой соли, например, селитры или квасцов, - все это не вызовет кристаллизации. Бросьте теперь в раствор самый крохотный кристаллик уксуснонатриевой соли. Этот кристаллик оказывается способным моментально выделить всю растворенную соль в твердом виде. Проделывая этот опыт перед аудиторией, можно обставить его весьма эффектно. Для этого надо особым образом подготовить кристаллик, вызывающий мгновенное превращение раствора в твердое тело. Расплавьте в фарфоровой чашечке немного парафина. Совершенно чистую стеклянную палочку опустите в расплавленный парафин и, пока он не застыл на ней, коснитесь палочкой кристаллика уксуснонатриевой соли. Он прилипнет к палочке. Окуните его на один момент в жидкий парафин и сбросьте в колбу с пересыщенным раствором. Тонкий слой парафина, облегающий поверхность кристаллика, воспрепятствует действию его на раствор. Показывая опыт аудитории, вы сможете вызвать мгновенную кристаллизацию в любой момент, - стоит вам, опустив стеклянную палочку в раствор, раздавить ею парафинированный кристаллик. Соприкосновение обнаженной поверхности кристалла с раствором тотчас вызовет выпадение в твердом виде всего количества уксуснонатриевой соли, в нем находившегося.
Если почему-либо уксуснонатриевой соли не достанете, можно заменить ее сернокислым натрием (глауберовой солью). Ее растворите до насыщения в горячей воде (градусов около 70), отфильтруйте раствор в меньшую колбу и, закрыв отверстие колбы комочком ваты, оставьте остыть в полном покое. В остывший раствор бросьте кристаллик глауберовой соли. Вы увидите, как быстро вокруг него станут нарастать звездообразно-игольчатые кристаллы, как возникнут они и в других местах раствора и также станут быстро расти. Секунда, и вся внутренность колбы заполнится ими. Раствор застыл в твердое тело.
О солях в природе и в технике
* (Значительно более подробно о том же сказано в другом труде автора: "Химия вокруг нас".)
Воды залива Кара-Бугаз (Каспийского моря) содержат в растворе минерал, носящий название "чудесный" (мираболит). Это, так сказать, минерал сезонный, то появляющийся, то исчезающий. По химическому составу это сернокислый натрий, выкристаллизовывающийся с 10 молекулами воды. Зимой воды залива стынут, мираболит выпадает из раствора и весенними бурями выбрасывается на берег. Как груды снега сверкает белая соль на солнце. Но солнце быстро прогревает неглубокие воды залива, и их волны "слизывают", вновь растворяют залежи мираболита.
Пользуясь временем, пока соль еще не смыта водой, ее собирали и везли за тысячи километров сначала караванами верблюдов, потом по железной дороге на заводы для переработки.
Но зачем везти так далеко почти двойной груз против действительно нужного, зачем везти вместе с глауберовой солью почти такое же по весу количество кристаллизационной воды?
Рациональнее переработку мираболита производить по месту его добычи. Но частным предпринимателям создание промышленного центра в местности, которую избегали посещать даже туземцы-кочевники, было не под-силу.
На богатства Кара-Бугаза еще в 1918 г. обратил внимание Ленин, и теперь в некогда бесплодной пустыне растет индустриальный центр, вырос и расширяется химический комбинат, перерабатывающий мираболит и ряд других ценных ископаемых, добываемых тут же поблизости.
Разностью растворимости при различных температурах пользуются у нас для эксплоатации поваренной соли наших многочисленных соляных озер, для получения ее испарением воды соляных источников и вымораживанием воды северных морей.
В технике эта разность используется для отделения солей разной растворимости из их смешанного раствора. При понижении температуры последнего из него сначала выкристаллизовываются труднорастворимые соли, а легкорастворимые остаются в маточном растворе.
Природными источниками технически применяемых солей СССР необычайно богат. Что нигде нет такого количества поваренной соли (каменной, в соляных озерах и источниках), это знали даже во времена царизма. Но вот, например, калиевые соли в прежнее время выписывались из Германии, а их месторождения у нас, оказывается, тоже являются богатейшими в мире. Вблизи Соликамска найдены и широко эксплоатируются месторождения калиевых солей. Кстати сказать, здесь при проходке первой шахты проявили чудеса производственного энтузиазма комсомольцы, впервые в СССР применившие метод замораживания грунта. А осенью 1934 г. и весной 1935 г. были открыты еще более мощные залежи калиевых солей вблизи Березников и в издревле известных Илецких пластах каменной соли. Теперь мы эти соли не ввозим, а, наоборот, экспортируем за границу.
А в Сибири у нас имеются озера с самородной содой, количество которой так велико, что ежегодно ее можно добывать больше, чем сейчас на заводах готовится из поваренной соли. Там же имеются озера с глауберовой солью. Интересно отметить, что еще в 1784 г. Лаксман применял сибирскую глауберову соль для варки стекла вместо соды. В Сибирь он был послан в качестве пастора, но, будучи по натуре естествоиспытателем, он от этой профессии вскоре отказался, занявшись исследованием природных богатств Сибири.
А этими богатствами обильна не только Сибирь, но и вся территория СССР, но многие из них до прихода к власти пролетариата оставались неизвестными.
Таковы, например, богатейшие и разнообразнейшие месторождения полезных ископаемых Кольского полуострова. Здесь, в первую очередь, надо отметить положительно неисчерпаемые источники апатито-нефелинов.
Вот что говорит об апатитах один из современных писателей*: "А. Н. Лабунцев, производивший изыскания на Кольском полуострове, решил попутно исследовать и гору Расвум-чарр, на вершине которой он подозревал наличие некоторых редких минералов. Забрав молотки, зубила и прочий несложный инструмент, геолог забрался на ровное плато, расположенное на высоте 900 м над уровнем моря. Плато оказалось усеянным крупными глыбами незнакомого ему камня. Отколов несколько кусков, геолог с недоумением ощупал необычайный минерал, рассыпчатый и белый.
* (Юрий Марк, "Конец Умпека", ГИХЛ, 1932 г.)
"Неужели апатит?
"По прибытии в Ленинград, а потом в Москву, ученый прочел ряд докладов. Привезенные им образцы породы показали ошеломляющие результаты.
"Таинственный камень оказался апатитом, не знающим себе равного в мире минерала по содержанию фосфорной кислоты. Лучшие фосфориты Марокко оказались в два раза хуже хибинских".
О нефелине тот же писатель пишет следующее: "Нефелин представляет собою мутный, обычно серый, полупрозрачный твердый камень, а по составу напоминает полевые шпаты, которые идут на получение фарфора и фаянса. Но он обладает своеобразным свойством: он необычайно легко разлагается даже слабыми кислотами. Нефелин завоевывает почетное место в стекольной, керамической, химической, металлургической, сельскохозяйственной, кожевенной, ультрамариновой и пр. видах промышленности. Нефелин - богатейший по применению в промышленности материал, и я нисколько не удивлюсь, если впоследствии нефелиновая проблема затемнит собою апатитовую. При варке стекла нефелин заменяет собою дефицитные соду и сульфат. В керамической промышленности он вполне заменяет полевой шпат. Легкая растворимость щелочей и извлекаемость из нефелина до 6%окиси калия делают нефелин ценным, легко усвояемым туком. Нефелин является также весьма ценным объектом для извлечения из него кремнезема и щелочей. Сода и поташ, которые могут быть приготовлены из нефелина, играют в химической промышленности столь же важную роль, как глина в керамической промышленности или каучук в резиновой. Наконец, из чистого глинозема, то-есть окиси алюминия, можно получить металлический алюминий, а из нефелинового сиенита - прекрасный, глубокого синего цвета ультрамарин. Не буду уже говорить о дублении подошвенной кожи нефелином, о получаемом из него титано-магнетите, идущем на изготовление белой, заменяющей свинцовые белила краски, о получаемом из нефелина ванадине..."
Все многообразные применения апатито-нефелиновых хибинских залежей в настоящее время используются. Не малая часть добычи экспортируется за границу. А ведь раньше фосфориты ввозились из-за границы.
В 1929 г. т. Киров заложил первый камень приполярного города Хибиногорска, ныне носящего имя Кирова и имеющего уже свыше 40000 жителей и крупные химические заводы, перерабатывающие апатито-нефелины и другие природные богатства Кольского полуострова.
И это там, где еще недавно была безлюдная тундра!
Зимний сад... летом
Кристаллы воды, когда они в виде инея покрывают зимой деревья в садах и лесах, так красивы каждый в отдельности и такую чудную картину образуют в целом, что можно только пожалеть о нашем неумении воспроизвести ее по желанию.
А впрочем, разве для химика есть что-либо невозможное! Целый сад мы инеем в жаркий летний день не покроем, - это обошлось бы слишком дорого, - но несколько веточек остролистника или хвойных кустарников и деревьев сможем покрыть нежными белыми кристаллами, которые дадут нам впечатление инея.
Поместим сорванные ветви под стеклянный колпак. Как я не раз говорил, им может служить бутылка с отрезанным дном. Колпак поставим на доску с прорезанным в середине ее отверстием, в которое вставим фарфоровую чашечку.
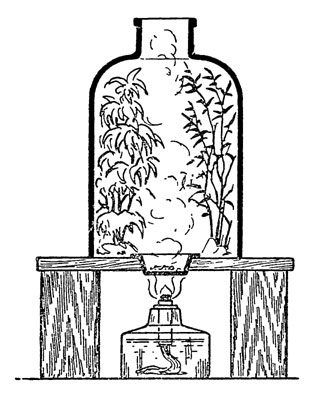
Рис. 47. Химический иней
В чашечку насыплем горсть бензойной кислоты (тело, при обыкновенной температуре твердое, как и многие другие кислоты, - хотя бы общеизвестная борная); под чашкой зажжем спиртовую лампочку (рис. 47).
При 120° бензойная кислота плавится, при 250° испаряется, и ее пары, наполнив колпак, осаждаются мелкими бесцветными кристалликами на ветвях и хвое растений. Уберите лампочку, закройте отверстие колпака пробкой и осветите картину "зимнего леса", выставив колпак на солнечный свет.
Сад химика
Химик может не только среди лета воспроизвести картину зимнего сада, покрытого инеем, - он может вырастить чисто "химический сад", не нуждаясь для этого ни в семенах, ни в саженцах растений.
Выращивается, однако, такой сад не на воздухе. Для растений, в нем произрастающих, нужна не углекислота, а другая питательная среда. Наоборот, все кислоты, даже следы их, гибельны для такого "сада".
Выращивается он в стекле.
- На стекле?
Нет, именно в стекле. Только в жидком, в так называемом растворимом стекле.
Бывает и такое стекло. Обыкновенное хорошо вам известное стекло с химической точки зрения - соль, хотя и нерастворимая или, говоря вполне точно, в высшей степени трудно растворимая в воде. Варится стекло чаще всего из песка (а песок - это кремнезем, ангидрид кремневой кислоты), соды и извести.
Попутно надо сказать, что и такое стекло при очень продолжительном кипячении в горячей воде частью переходит в раствор. Это доказал Лявуазье, опровергнув мнение своих современников, утверждавших, что при многодневном кипячении воды из нее выделяется какое-то новое землистое вещество. Взвесив это вещество, он нашел, что вес его равен разности весов стеклянного сосуда до и после опыта. Ясно, что и получилось оно не из воды, а из материала сосуда.
Сплав кремнезема с едким натром дает стекло, легко растворимое в воде и очень легко разлагаемое кислотами. В виду последнего, материалы для нашего химического сада должны быть совершенно чистыми, иначе, предупреждаю заранее, ничего из этого опыта не выйдет.

Рис. 48. Кристаллические растения
Купив силикат натрия уже в растворенном виде, слейте его в широкую банку из-под варенья из бесцветного стекла и бросьте в жидкость крохотный кристаллик медного купороса. Упав на дно, он вскоре покроется пленкой, которая в непродолжительном времени образует почки, а из этих почек начнут расти голубые травинки. Ими можно засеять все дно банки; это будет газон голубой "химической травы" (рис. 48). На Земле, правда, такая трава не встречается, но, быть может, что-нибудь в этом роде растет на других планетах...
Кристаллик железного купороса дает извивающиеся черные ветви; никелевого - ярко-зеленые, почти прямые стволики; азотно-кислый кобальт разовьется в синие ползучие растения и т. п.
Сулема (хлорная ртуть) - сильный яд, так что брать ее для этого опыта отнюдь не следует, а это отчасти жаль, так как она дает очень красивые оранжевые "растения".
Когда деревья "вырастут", можете очень осторожно слить раствор стекла. Сад будет оставаться таким же, как получился, и в воздухе; воздух был непригоден только для периода развития химических трав и деревьев.
А растут они вот почему: в растворе жидкого стекла кристаллики солей тяжелых металлов покрываются тонкой пленкой их кремнекислых соединений. Сквозь эту пленку диффундирует (проникает) вода и растворяет часть кристаллика. Пленка, не выдержав напора изнутри, где-нибудь лопается, растворившаяся соль тяжелого металла вытекает в отверстие и тотчас в свою очередь покрывается пленкой кремнекислой соли. Процесс этот может повторяться несколько раз, и тогда "химическое растение" ветвится.
Растворимое стекло представляет не единственную "питательную среду" для химических растений.
Заменив его крепким раствором желтой кровяной соли (железисто-синеродистый калий), можно из солей тех же металлов вырастить в этом растворе растения других "семейств", не похожие на прежние.
Так, кристаллик медного купороса, дающий в растворимом стекле голубую травку, в кровяной соли развивается в красно-бурое деревцо, по началу стелящееся по дну банки, а затем вырастающее до самой поверхности раствора. Наоборот, азотно-кислый кобальт дает в этом растворе низкую траву.
Чем не аналогия с биологическим законом приспособляемости организма к окружающей среде?
Но, конечно, химические "растения" отличаются от настоящих: семян они не дают, клеток органических не имеют.
Словом, они не живые!
"Сатурново дерево"
Алхимики называли металлы именами мифологических богов древней Эллады. Свинец они называли Сатурном (бог времени - отец всех богов), ртуть - Меркурием (бог воровства - был и такой) и т. д.
Вот почему дендритные (растениеобразные) скопления искусственно выкрашенных кристалликов свинца и носили у них название "сатурнова дерева".
Но не кажется ли вам задача получения металла, хотя бы и такого легкоплавкого, как свинец, в правильных кристаллах, при наших более чем скромных средствах, при отсутствии плавильной печи и огнеупорных тиглей, неразрешимой?
Нет, плавить свинец или хотя бы растворять его в чем-либо, чтобы выделить, как делали с кристаллами солей, осаждением из раствора, нам не придется.
В этом опыте мы пойдем совсем другим путем, мы вытесним металлический свинец другим металлом из раствора его уксуснокислой соли (свинцового сахара).
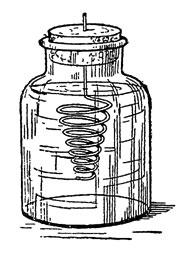
Рис. 49. Получение 'Сатурнова дерева'
Для этого мы нальем в небольшую широкогорлую баночку (рис. 49) профильтрованный насыщенный раствор названной соли и закроем банку пробкой, в которую снизу вколота спирально изогнутая цинковая проволока. Проволока предварительно должна быть очищена наждачной бумагой от покрывающего ее поверхность окисла и обезжирена промывкой в эфире или крепком спирте.
Уже через несколько минут мы заметим, что поверхность проволоки по всей длине спирали начнет покрываться крохотными кристалликами свинца. Оставьте прибор на сутки, и у вас получится ветвистое "сатурново дерево" древних алхимиков.
Цинк вытеснит из раствора свинцовой соли металлический свинец, а в растворе окажется уксуснокислая соль цинка.
Кристаллизация металлов
Лет 20 тому назад химик В. Александров усовершенствовал постановку предыдущего опыта алхимиков, сконструировав для него особый приборчик.
Как видите (рис. 50), это обыкновенная пробирка, самая широкая, какую мне удалось найти. Через плотно входящий в нее кружок желтого картона, вдвинутого до половины высоты пробирки, пропущена медная проволока, верхним концом припаянная к цинковому кольцу. Ширина кольца 1 см, таково же и расстояние его от картонного кружка. Снизу проволока доходит почти до дна пробирки. На расстоянии между цинковым кольцом и картонным кружком она покрыта слоем расплавленного сургуча, сургучем же она приклеена к картону.
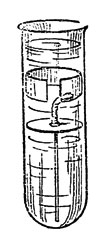
Рис. 50. Кристаллизация металлов
Наливаю предварительно в пробирку насыщенный раствор свинцового сахара до половины высоты пробирки, на него опускаю картонный кружок и сверху последнего наливаю раствор селитры так, чтобы он стоял выше цинкового кольца.
Пробирку ставлю в станочек. Наш приборчик - маленький гальванический элемент. В нем возникает ток, ускоряющий выделение металлического свинца.
Смотрите. Не прошло и 15 минут, а наше "сатурново дерево" уже выросло внутри пробирки.
Приборчик хорош тем, что в нем можно получать кристаллы и других металлов, а не только свинца.
Заменив свинцовую соль раствором хлористого олова, подкисленного несколькими каплями соляной кислоты, а раствор селитры - раствором поваренной соли, заметим через 15 минут возникновение у перегородки блестящих кристалликов олова. Через несколько часов они заполнят всю нижнюю часть пробирки.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'