
Приложение III
Основные химические законы
* (По курсу неорганической химии В. Ипатьева и А. Сапожникова.)
Закон сохранения материи. При всех химических превращениях веществ друг в друга их общее весовое количество остается неизменным. Вещества только меняют свои химические и физические свойства. Материя не творится и не уничтожается.
Закон сохранения энергии. Всякая причина, могущая произвести работу, называется энергией. Энергия не исчезает и не появляется сама собою. Во всех случаях проявления данного вида энергии она образуется из эквивалентного (равноценного) ей количества другого вида. При реакциях экзотермических химическая энергия взаимодействующих веществ полностью или частично превращается в энергию тепловую, при реакциях эндотермических для совершения их извне затрачивается тепловая энергия.
Закон постоянства состава. В определенных химических соединениях весовое отношение частей постоянно.
Закон кратных отношений. Если два тела образуют между собою несколько соединений, то, приняв весовое количество одного тела за величину постоянную, найдем, что весовые количества другого тела будут находиться между собою в простых кратных отношениях.
Закон Авогадро. В равных объемах газов при одинаковых физических условиях находится одинаковое число молекул.
Закон Авогадро - Жерара. Молекулы химических веществ, находящихся в газо- или парообразном состоянии, при одинаковых физических условиях занимают равные объемы.
Закон валентности элементов. Валентность (значность, атомность) есть способность атома элемента удерживать или замещать один или несколько атомов водорода, валентность которого (число единиц сродства) принята за единицу.
При соединении элементов единица сродства одного из них насыщается единицей сродства другого элемента. Так, кислород, будучи двувалентным, соединяется с двумя атомами водорода.
Эквивалентным весом (эквивалентом) элемента называется то его весовое количество, которое заменяет одну весовую единицу водорода. Для одновалентных элементов эквивалент равен их атомному весу, для двувалентных - половине, Вообще, эквивалент есть частное от деления атомного веса на валентность.
Закон Менделеева
Мы видели, что химические элементы делятся на металлы и металлоиды. Резкого разграничения в данном случае не имеется. Так, мышьяк и сурьма в чистом виде имеют свойства металлов, в соединениях - металлоидов. Йод и бром, будучи характерными металлоидами в чистом виде, способны в некоторых соединениях проявлять свойства металлов; хром и марганец в одних соединениях, как и в чистом виде, - резко выраженные металлы, в других - металлоиды.
Заметно также деление элементов на группы по сходству их свойств.
Менделеев, исходя из предположения, что свойства элементов находятся в зависимости от их атомного веса, классифицировал все известные в его время простые вещества, расположив их в виде особой таблицы. В современном, исправленном и дополненном, виде она приведена на следующей странице. Из нее видно, что свойства элементов находятся в периодической зависимости от их атомных весов. По мере количественного возрастания атомного веса изменяется качество элементов.
"Ряды в пределах которых совершается последовательно изменение свойств элементов, Менделеев назвал периодами. В двух периодах - от щелочного металла лития до галлоида фтора и инертного газа аргона - находится по 8 элементов. Это малые периоды. В следующих двух - больших периодах, третьем и четвертом между щелочным металлом и инертным газом, расположено по 18 элементов, в третьем большом периоде - 32 элемента и в последнем периоде, незавершенном, - 6 элементов.
"Большие периоды отличаются от малых не только тем, что в них большее число элементов, но и тем, что в них большинство элементов - металлы, и только в конце появляются металлоиды.
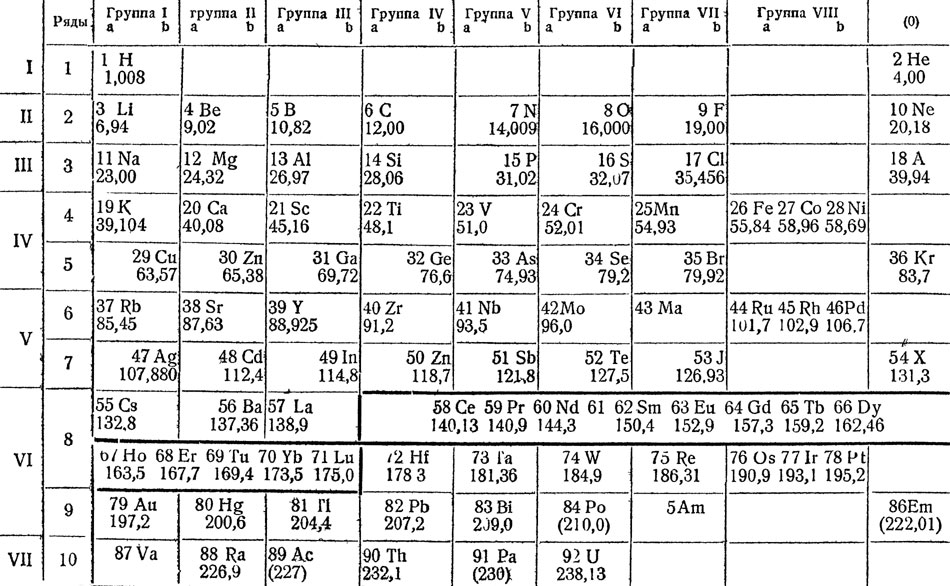
Периодическая система элементов по Д. И. Менделееву
"Большие периоды так же, как и малые, начинаются энергичными металлами, сходными с литием и натрием, но затем уменьшение металлических свойств и нарастание металлоидных идет медленно, и только в самом конце появляются металлоиды. Однако, в больших периодах есть одно свойство, по которому каждый большой период может быть разбит на две части, соответствующие малым периодам. Это валентность высших солеобразующих окислов.
"Если мы проследим изменение валентности элементов больших периодов по кислороду, то найдем, что сначала эта валентность повышается от единицы до семи, после чего идут три весьма сходных между собою элемента с одинаковой валентностью - восемь, а затем валентность падает до единицы и далее снова возрастает до семи, после чего падает до нуля.
"Таким образом, оказывается возможным поместить элементы больших периодов под имеющими соответственную валентность элементами малых периодов, при чем получаются столбцы элементов с одинаковой валентностью.
"В таблице имеется 10 рядов, причем в первом ряду стоят только два самых легких элемента - водород и гелий.
"Перед каждым символом элемента поставлена цифра,- это нумерация элементов по порядку, в каком они следуют один за другим, - порядковые номера. Под названиями элементов помещены атомные веса.
"Элементы в таблице образуют 9 столбцов или групп элементов с одинаковой валентностью. Последняя группа - группа инертных газов, не вступающих в соединения, обладающих "нулевой валентностью", обозначена нулем - нулевая группа".
"Внизу таблицы даны типы соответствующих элементам групп высших солеобразующих окислов, при чем вместо знака элемента поставлена буква R, не являющаяся символом какого-либо определенного элемента. Ниже даны типы высших газообразных водородных соединений, известных только для IV-VII групп. Как видно из этих типовых формул, валентность элементов по водороду, с увеличением атомного веса, в горизонтальных рядах уменьшается. Например, хлор, семивалентный по кислороду, образует с водородом соединение типа RH, а именно хлористый водород. Здесь хлор одновалентен. Следует отметить, что сумма валентностей по кислороду и водороду оказывается постоянной и равна 8".
"Когда Менделеев вырабатывал таблицу элементов, руководствуясь периодическим законом, ему было известно только 64 элемента, тогда как теперь мы знаем 92 элемента. Поэтому в первой таблице Менделеева оказалось много пустых мест, и между прочим там, где теперь стоят элементы скандий Sc (4-й ряд III гр.), галлий Ga (5-й ряд III гр.) и германий Ge (5-й ряд IV гр.).
"В то время соответствующие элементы еще не были известны, а другие элементы, близкие по атомному весу, не могли занять указанных мест, так как не подходили к ним по своим свойствам и по типу соединений. Опираясь на периодический закон, Д. И. Менделеев в 1871 г. высказал убеждение, что должны существовать элементы, места которых указываются этими промежутками.
"На основании точного знания свойств элементов, расположенных рядом с этими пробелами в вертикальном и горизонтальном направлениях, Д. И. Менделеев уже тогда определил возможные величины атомных весов этих элементов, а также указал, какими свойствами должны обладать сами эти элементы в виде простых веществ, какие соединения они могли бы образовать и какими свойствами эти соединения должны отличаться. Предсказания Д. И. Менделеева с полной точностью подтвердились. Недостающие элементы были открыты еще при жизни Менделеева"*.
* (По книге проф. В. Н. Верховского - "Химия", ч. III, Учпедгиз, 1933 г.)
Предсказание Менделеева о возможности открытия новых элементов с указанием их свойств часто сравнивают с другим научным "дальновидением" - с предсказанием астронома Леверье о существовании неизвестной планеты в нашей Солнечной системе. Действительно, такая планета, названная Нептуном, была открыта. Часто говорят, что Леверье открыл Нептуна "на кончике своего пера". С неменьшим правом можно сказать и о Менделееве, что он своим пером открыл все до него не бывшие известными элементы.
Современный взгляд на строение вещества
Менделеев, согласно научным данным его времени, считал атом не разлагаемым на какие-либо составные части и имеющим постоянный вес, характеризующий свойства данного вида материи-того или иного химического элемента.
Новейшие достижения физики показали ошибочность этого взгляда.
Атом не является пределом деления материи. Он состоит из центрального ядра и окружающих его электронов. Состав ядер атомов в свою очередь сложен. Они заряжены положительно, а окружающие их внешние электроны - отрицательно. Химические свойства атома зависят от числа внешних электронов, а атомный вес - от числа протонов ядра. Новейшие исследования показали, что атомный вес, например, хлора не потому равен 35,456, что атом хлора в 35,456 раз тяжелее атома водорода, а потому, что в хлоре, откуда бы он ни был получен, мы всегда имеем смесь атомов с атомными весами, в 35 и в 36 раз большими атомного веса водорода в определенном отношений друг к другу. Те и другие имеют 17 внешних электронов, а потому по своим химическим свойствам и не отличаются друг от друга. Такие одинаковые по числу электронов атомы, имеющие различный атомный вес, носят название изотопов (стоящих на том же месте таблицы Менделеева). Отсюда вытекает следствие, что свойства элементов зависят от их порядкового номера в таблице Менделеева, находясь от него в той периодической зависимости, которая была Менделеевым указана.
Новейшие достижения науки не поколебали периодический закон нашего великого химика, а уточнили и развили его.
Перечень наиболее применяемых в технике элементов
Водород (Н). Для наполнения аэростатов, для реакций восстановления, для крэкинга нефти, т. е. отделения от нее легкокипящих продуктов перегонки, для гидрогенизации твердого топлива ("искусственная нефть" из каменного угля), гидрогенизации жидких жиров в твердые.
Гелий (He). Для наполнения дирижаблей (не горюч!) и газосвечных ламп (светит красным светом, проникающим через туман).
Аргон (Ar), Неон (Ne) и Криптон (Kr). Для газосветных ламп.
Углерод (С). В виде угля - как топливо; в виде графита - тигли, сухая смазка, карандаши, краски; в виде алмаза - для резки стекла, для наконечников буров, для шлифовки. В бесчисленных соединениях имеет разнообразнейшие применения. Например, в соединениях с водородом, как светильный газ, газообразное и жидкое топливо.
Азот (N). Газосветные лампы, азотирование стали, в синтезе аммиака и азотистых соединений. Соединения: вещества взрывчатые, удобрения, краски, пищевые вещества (так называемые белковые).
Кислород (О). Автогенная сварка в смеси с водородом и другими горючими газами, взрывчатый оксиликвит в смеси с угольной пылью, для дыхания в подлодках и гондолах стратостатов. В соединениях с металлами - кислородные руды, краски, окислы, разнообразные применения в химпроизводствах и металлургии.
Кремний (Si). В соединении с кислородом (кремнезем); кварцевое стекло, для строительного дела (песок), в керамике, в стекольном производстве, для химической аппаратуры, в электротехнике (изоляторы), цементное производство, бетон и пр.
Фосфор (Р). Спички, удобрения, отравляющие вещества, сплав с медью (фосфористая бронза).
Мышьяк (As). Отравляющие вещества, краски, лекарства.
Сурьма (Sb). Сплавы, краски.
Висмут (Bi). Легкоплавкие сплавы, краски, лекарства, керамика.
Сера (S). Серная кислота, сернистые краски, инзектотоксин (вещества, отравляющие насекомых и вообще вредителей).
Селен (Se). В электротехнике (меняет свою электропроводимость в зависимости от степени освещения, отсюда ранее применялся в телевизорах и т. п. устройствах).
Фтор (F). Для травления стекла, в электротехнике, в керамике, в металлургии.
Хлор (Сl). Беление, дезинфекция, отравляющие вещества, краски.
Бром (Br). Краски, лекарства.
Йод (I). Лекарства, краски.
Натрий (На) и Калий (К). В фотоэлементах, в виде солей в химпроизводствах, в медицине, удобрения (селитры).
Медь (Cu). Применение общеизвестно, в соединениях - краски.
Серебро (Ag) и Золото (Au). Применение общеизвестно, в соединениях - в фотографии и стекольном производстве.
Магний (Mg). Для освещения, в соединениях (магнезиты) в строительном деле, в сплавах для легких металлов.
Кальций (Са). В виде извести и известняков в строительном деле, для удобрений, в химических производствах и пр.
Барий (Ва). Для белил.
Ртуть (Hg). Краски, лекарства, в технике.
Алюминий (Al). В чистом виде присадка к стали и в сплавах в авиастроении и машиностроении, в соединениях для очистки воды (квасцы), в красильном деле, в химических производствах, в нефтяном деле и пр.
Олово (Sn). Подуда, паяние, легкоплавкие сплавы, в соединениях в керамике и красильном деле (белила).
Свинец (Рl). Водопроводное дело, химаппаратура, типографский и легкоплавкие сплавы, в соединениях краски (сурик для окраску металлических изделий, белила).
Хром (Cr). Для хромирования металлов, для изготовления Хромовой и нержавеющей стали, в соединениях в красильном деле и как окислитель (хромовый ангидрид) в химпроизводствах.
Вольфрам (W). В электротехнике (нити ламп), в металлургии для сверхтвердых сплавов.
Марганец (Mn). Присадка к стали, придающая исключительную прочность, в соединениях в красильном деле, как дезинфектор.
Железо (Fe). Применение в виде чугуна (сплав железа с углеродом и другими присадками) и различных сортов стали общеизвестно, в соединениях в красильном деле, как инзектотоксин, в медицине.
Никкель (Ni). Для никкелирования, присадка к стали для увеличения вязкости, в соединениях в красильном деле и для изготовления красок.
Кобальт (Со). В последнее время для кобальтирования (покрытия слоем кобальта других металлов), в соединениях - как краски, для производства специальной стали.
Платина (Pt). Химическая аппаратура и лабораторная посуда, в электротехнике, соединения в фотографии. Губчатая платина в химпроизводствах, как абсорбирующее (сгущающее на поверхности газы) вещество.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'