
3.4. Электронная пара
Атомы обладают разным числом электронов. У самого маленького атома-водорода-всего один электрон, а у самых больших атомов их больше ста: у атома урана, например, 92 электрона. Следовательно, существует больше ста разных типов атомов. В каждом из них имеется свое ядро, положительный заряд которого должен точно уравновесить отрицательный заряд всех электронов атома.
Два электрона (но не больше) могут соединиться в пару, чтобы образовать и заселить общую волну. Однако вовсе не обязательно, что пару могут составить два любых, взятых наобум электрона. Каждый электрон имеет особое сокровенное свойство, нечто такое, что должно найти в партнере по паре свою противоположность. Для того чтобы изобразить электронную пару, образующую волну, рисуют две противоположно направленные стрелки. А электрон-одиночка изображается одной стрелкой.
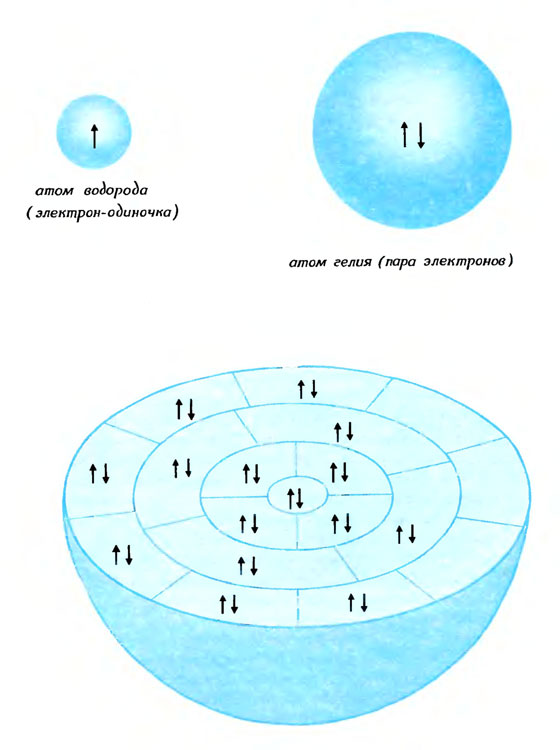
Заполнение атома электронами по слоям
Таким образом, шарообразную волну атома водорода занимает электрон-одиночка, тогда как у атома гелия в очень похожем шаре умещается пара электронов. В более сложных атомах электронные пары заселяют и другие типы волн. Заполнение этих волн происходит очень методично, как в луковице, слой за слоем. В каждом слое волны одинаково доступны электронам. Внутри слоя каждая пара занимает свою собственную, волну, изображенную на рисунке клеточкой. Несформировавшиеся и не занятые электронами волны считаются пустыми. Как некая абстракция эти волны существуют и без электронов, однако пока в них нет электронов, они никакой роли не играют.
Атомы с заполненными слоями особенно устойчивы. А два атома с одинаковым числом электронов во внешнем слое имеют очень похожие свойства. Именно это мы наблюдаем в случае атомов лития и натрия. И как раз в этом заключается смысл классификации атомов, разработанной Д. И. Менделеевым.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'