
Глава III. Литий - самый легкий металл
Состояние в природе и получение. Литий - самый легкий из всех металлов - был открыт в 1817 г. Арфведсеном при исследовании минерала петалита. Минерал этот обнаружил еще в 1800 г. в Швеции бразильский ученый де-Андрада-е Сильва; этот же исследователь нашел в Швеции и другой минерал - лепидолит, также содержащий литий.
По предложению Берцелиуса новый элемент получил название "литий", произведенное от греческого "литое", что значит камень. Несмотря на то что Дэви и Бранде в 1818 г. удалось выделить небольшие количества лития, применяя метод электролиза к гидроксиду лития, промышленное получение металла было налажено гораздо позднее (в 1855 г.), когда в качестве сырья стали использовать хлорид лития.
Хлорид лития получают путем химической переработки минералов лепидолита, петалита, амблигонита, сподумена и др. Силикаты, содержащие литий, широко распространены в природе. Их известно около 1500. Содержание лития в земной коре составляет 5-10-3 % по массе. Литий в виде соединений можно обнаружить не только в минералах, но и в воде различных источников, в морской воде и даже в растениях (сахарной свекле, табаке, хмеле, чае и др.). Обычно литий встречается вместе с натрием и калием, что вполне естественно, так как все они - представители одной общей группы - щелочных металлов. Промышленное использование минерала выгодно лишь, когда содержание лития (в расчете на оксид) составляет не менее одного процента. Промышленное значение имеет литиевая слюда - лепидолит LiK2Al3 [Al(Si3O10)2OHF]4, представляющий собой беловатые или слегка розовые листочки гидроксиалюмосиликата лития, калия и алюминия. Лепидолит - обычное сырье для получения лития. Другой минерал - сподумен (из группы пироксенов), встречается вместе с кварцем и полевыми шпатами и также используется для получения лития. Его состав менее сложен: LiAl[SiO3]2, это сероватые блестящие кристаллы.
Переработка сподумена или лепидолита производится с целью получения хорошо растворимых солей лития - хлорида и сульфата. Для этого минералы сначала "обогащают", применяя метод флотации. Получается "рудный концентрат", т. е. сырье, содержащее повышенное по сравнению с исходной рудой количество лития на единицу массы. После этого начинается собственно химическая переработка. Суть ее состоит в разложении сложных алюмосиликатов. Разложение производят различными способами. Можно, например, растворить руду в горячей серной кислоте или обработать ее при сплавлении (температура 1050-1200 °С) сульфатом калия или хлоридом кальция. Рассмотрим реакции, происходящие при нагревании до 350 °С сподумена с серной кислотой:
2LiAl[SiO3]2+H2SO4-Li2SO4 + Al2O3⋅4SiO2⋅H2O
Сульфат лития хорошо растворим в воде, его можно отделить от плохо растворимого силиката алюминия Al2O3-4SiO2-H2O; примеси ионов железа, кальция, магния удаляют добавлением небольших количеств карбоната калия и натрия. С хлоридом кальция сподумен образует хлорид лития и алюмосиликат кальция:
2LiAl[SiO3]2 + CaCl2 = 2LiCl + Al2O3⋅4SiO2⋅CaO
Полученные этими методами соли лития являются и сами по себе ценным сырьем для ряда отраслей промышленности. Они также служат для выделения металлического лития.
В настоящее время металлический литий получают электролизом расплавленной смеси хлоридов лития и калия при 400-450 °С. Катоды в электролитических ваннах железные, а аноды графитовые, На катоде протекает реакция:
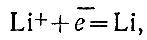
на аноде:
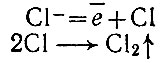
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'