
Глава IV. Натрий
История открытия
Уже в давние времена (еще в древнем Египте) из природных соединений этого элемента и из золы растений получали растворы, обладавшие хорошим моющим действием; сейчас мы назвали бы их щелочными. Они действительно содержали вещества, дающие в водном растворе щелочную реакцию,- карбонаты натрия и калия. Египтяне, греки, римляне применяли эти растворы не только для мытья, но и в некоторых химических производствах, в частности для изготовления глазурей. Щелочные растворы назывались "нитрон" или "натрон". Арабские химики пользовались другим термином - они называли щелочи "алкали". Именно отсюда в конце концов и появились названия натрий и алкалиметрия (т. е. определение щелочей в аналитической химии).
Надо заметить, что в древности не делали различий между калиевыми и натриевыми соединениями. Лишь в XVII в. пришли к заключению, что щелочной раствор, получаемый из золы растений, отличается от щелочи, полученной из минеральных веществ. На самом деле в золе растений содержится главным образом карбонат калия (поташ), а из минеральных источников извлекаются в основном соединения натрия. В XVIII в. А. Клапрот ввел термины "натрон" для минеральной щелочи и "кали" - для растительной. После того как удалось получить оба металла в свободном состоянии, были предложены названия "потассий" (для калия) и "содий" (для натрия). Несколькими годами позже даты получения металлов (1807 г.) И. Берцелиус назвал эти металлы "натрий" и "калий", т. е. так же, как мы их называем и ныне. Однако во французском и английском языках и в настоящее время натрий называют "содием".
Оба металла (натрий и калий) были открыты практически одновременно. Их открытие представляет собой яркий пример того, каким важным и плодотворным событием в науке является исследование новых сил природы, Рубеж XVIII и XIX вв. ознаменовался крупными успехами в изучении электрического тока. Работы Гальвани и Вольта дали в руки физиков и химиков новое и мощное средство воздействия на вещество. В 1807 г. талантливый английский ученый Гэмфри Дэви, которому еще в 1800 г. удалось разложить электрическим током воду, попробовал применить электричество для исследования щелочей. Щелочи вызывали сомнения - было не ясно, представляют ли они собой простые или сложные вещества. Осторожный А. Лавуазье предусмотрительно исключил их из списка простых веществ, высказав предположения, что щелочи будут когда-нибудь разложены.
Дэви помещает в платиновый тигель щелочь (гидроксид калия), расплавляет ее, погружает в расплав платиновую проволоку и соединяет тигель и проволоку с концами проводов знаменитого в те времена "вольтова столба". Вольтов столб состоял из дискообразных цинковых и медных пластинок, сложенных попарно (цинк - медь) и прослоенных кружочками ткани, пропитанной раствором серной кислоты. Это была по существу батарея гальванических элементов: 250 пластинок обеспечивают получение достаточного тока. Платиновая проволока служила Дэви анодом. Металлический калий выделился на стенках тигля. Яркие вспышки и рассыпающиеся искры, сопровождавшие появление на поверхности расплава блестящих шариков металла, показали Г. Дэви, что перед ним действительно новое простое вещество. Аналогичный опыт с натриевой щелочью привел к открытию натрия. Пламя вспышек шариков расплавленного калия было окрашено в сине-фиолетовый цвет, а пламя вспышек натрия было ярко-желтым. Позже тем же методом Дэви выделил и другие металлы - магний, стронций, барий и кальций; так начался период развития электрохимии.
В наши дни электрохимические производства представляют собой важнейшую отрасль химической индустрии.
Получение натрия. Натрий и сейчас получают электролизом расплавленного гидроксида. Электролитическая ванна (рис. 8) - это железный сосуд, в который по гружены угольные или железные катоды и цилиндрические никелевые или железные аноды. Процесс электролиза ведется при нагревании (выше 325 °С). При этом на катоде протекает реакция восстановления:
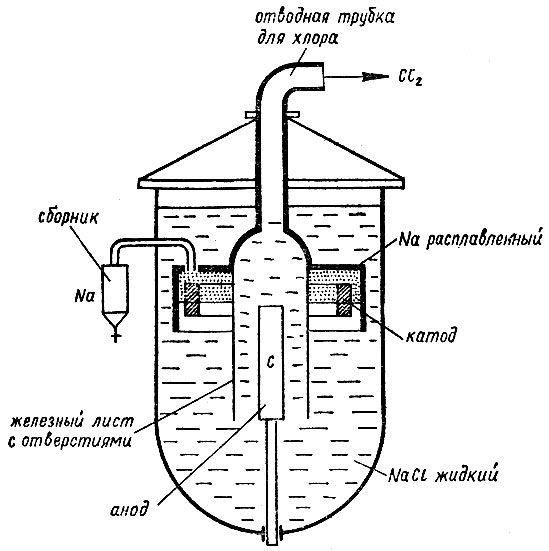
Рис. 8. Схема электролитического получения натрия
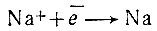
Металлический натрий, выделившийся на катоде, всплывает в верхнюю часть ванны, причем специальная металлическая диафрагма. препятствует проникновению жидкого металла в анодное пространство. На аноде разряжаются ионы гидроксида ОН-, потеряв электроны, они образуют воду и кислород:
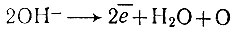
Атомы кислорода соединяются в молекулы. Следовательно, продуктами элетролиза являются натрий, кислород и вода. Вода частично испаряется, а частично подвергается разложению - электролизу, на катоде при этом появляется водород, а на аноде опять же кислород.
Этот способ получения натрия имеет существенный недостаток - он дорог из-за сравнительно высокой стоимости сырья - гидроксида натрия. Поэтому электролитическое получение натрия целесообразно на основе использования более дешевого продукта, именно хлорида натрия. В настоящее время электролиз хлорида практически вытеснил все другие способы.
Разложение электрическим током расплавленного хлорида натрия произвести не просто. Хлорид (поваренная соль) плавится лишь при 800 °С. При такой температуре металлический натрий почти весь испаряется, да и сама соль начинает уже кипеть при 882 °С. Натрий в раскаленном парообразном состоянии очень активен - он быстро окисляется, реагирует с футеровкой электролитических ванн, растворяется в расплаве, осложняя и затрудняя технологический процесс. Выход из положения нашли, добавив к исходному сырью (хлориду натрия) немного других солей (хлорид калия, хлорид кальция, фторид натрия и др.). Добавление к чистому веществу примесей, которые в нем растворяются, понижает температуру плавления - такие смеси плавятся ниже, чем чистое вещество. Таким способом удалось понизить рабочую температуру процесса электролиза до 575-585°С, что уже вполне приемлемо.
Расплавленный натрий всплывает над катодом и попадает в специальный сборник. Над анодом помещают колпак, в который уходит выделяющийся на аноде хлор. Уравнения процесса довольно просты:
на катоде
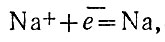
на аноде
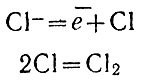
Природные образования натрия. Соединения натрия редко встречаются "в одиночку", чаще всего им сопутствуют соли других металлов. Процессы образования земной коры, протекавшие при высоких температурах, закончились формированием огромных масс минералов. Натрий и калий оказались в верхних частях кристаллизующейся магмы и вошли в состав гранитов, но дальнейшая судьба у них была различна. Дело в том, что соли натрия очень хорошо растворимы в воде (исключение составляют периодат натрия NaIO4, гексагидроксоантимонат NaSb(OH)6 и некоторые двойные соли) и легко вымываются грунтовыми водами. Натрий в виде его солей в конце концов был удален из этих веществ и унесен в моря и океаны.
Соединения калия отличаются индивидуальной особенностью - они особенно хорошо поглощаются почвой. Таким образом, натрий и калий расстались! Волны древнего пермского моря омывали огромную территорию от донецкого бассейна до Урала. Когда это море начало постепенно мелеть и высыхать, в северной его части образовались отложения гипса и поваренной соли, а от Соликамска до Уральского хребта выделились и осели огромные массы солей натрия и калия. В той или иной мере этот процесс характерен и для других районов, в которых возникали залежи хлорида натрия - каменной соли.
В Польской Народной Республике в районе Велички находятся старые разработки пластов минералов каменной соли. Это настоящий музей. Подземные коридоры тянутся на сотни километров. Удивительное и необыкновенно красивое зрелище представляют собой крупные кристаллы каменной соли, образующие стены и потолки огромных подземных помещений, слегка подсвеченных и украшенных скульптурами, изваянными из соли. Барельефы, статуи, архитектурные украшения превращают старые шахты в фантастические дворцы. Соль, оказывается, не всегда бывает белой. В Величке можно увидеть образцы синей, зеленоватой и красноватой соли. Синяя окраска, как полагают, связана с длительным воздействием радиоактивных излучений, источником которых были минералы, содержавшие тяжелые элементы, а также радиоактивный изотоп калия с атомной массой 40.
Радиация возбуждала электроны ионов хлора, и некоторые из них утрачивали связь с ионами хлора. Хлорионы, превращаясь в атомы, а затем в молекулы, постепенно покидали кристалл, а на их месте оставались электроны, выполняющие функции анионов. Наличие таких "дефектных" мест в кристалле и обусловливает изменение окраски. В музее города Велички в книге для почетных посетителей можно видеть подпись Д. И. Менделеева, посетившего соляные разработки, еще когда он был доцентом Петербургского университета.
Содержание натрия в земной коре составляет 2,64 % (по массе). Это много, и большая часть всего натрия приходится именно на хлорид натрия (его минералогическое название - галит или каменная соль). Подсчитано, что если извлечь из недр земли весь хлорид натрия, то можно было бы покрыть всю поверхность земного шара слоем соли толщиной в несколько метров. Каменная соль в виде мощных скоплений встречается в ряде стран; в Советском Союзе, в Австрии (район Зальцбурга), в Польской Народной Республике (Величка), в США (Техас и Оклахома) и др. Воды океанов содержат около 2,8 % хлорида натрия, причем величина эта практически постоянна. Во внутренних морях, таких, как Средиземное, содержание хлорида натрия выше - 3,1%. В Мертвом море, вода которого насыщена солями, содержание хлорида натрия составляет 7,9 %. В СССР большие количества этой соли сосредоточены в озерах Эльтон и Баскунчак.
В Мировом океане содержится колоссальное количество хлорида натрия. По приблизительным подсчетам оно составляет 4⋅1015 т (4 000 000 000 000 000 т). Хлорид натрия содержится даже в воздухе. Он попадает туда в результате испарения бесчисленного множества мельчайших брызг морской воды и разносится на большие расстояния. С поверхности Каспийского моря за сутки в атмосферу попадает несколько тысяч тонн соли. Хлорид натрия был обнаружен в тех капельках воды, которые образуют облака. Из всех солей натрия хлорид имеет наибольшее значение. Его добывают и в виде рассола, накачивая воду непосредственно в грунт в местах залегания соли, его извлекают в виде кусков каменной соли или получают из самосадочных озер вместе с другими солями.
Обычная поваренная соль всегда содержит примеси солей калия, магния, кальция и других металлов. Абсолютно чистый хлорид натрия важен только для научных целей. Небольшое количество примесей в поваренной соли не только не вредно, но и по всем данным необходимо для организма человека и животных; все обычные "спутники" натрия выполняют специальные и важные биологические функции в клетках. Промышленность использует хлорид натрия для многих целей. Соль идет для производства хлора, щелочей, хлоратов и гипохлоритов, водорода, гидроксида натрия, соды, различных продуктов в синтетической химии, лекарственных веществ, красителей и др.
Залежи каменной соли предложено использовать для создания подземных хранилищ нефти или газов. Дело в том, что кристаллы каменной соли непроницаемы для жидких и газообразных веществ, и промыванием водой удалив из залежей соли большую часть хлорида натрия, можно получить под землей замкнутую емкость с прочными стенками, нечто вроде подземного бака, в котором и нефть, и газ могут храниться очень долго.
В Чили, Перу, Колумбии, Боливии, Аргентине и в некоторых сухих районах СССР имеются залежи нитрата натрия. Эта соль очень хорошо растворяется в воде, и поэтому ее скопления могли образоваться и сохраниться лишь там, где грунтовые воды и дожди не оказывали влияние на процессы превращения азотсодержащих органических остатков в минеральные соли. Особенно значительные скопления нитрата натрия образовались в пустыне Атакама (Чили), отличающейся исключительно сухим климатом. В настоящее время они почти полностью истощены. В СССР, в Гренландии и некоторых других странах встречается минерал криолит - бесцветные и желтовато-красные (за счет примесей) кристаллы, которые представляют собой соединение комплексного типа, содержащее натрий, фтор и алюминий Na3AlF6; этот минерал играет важную роль в технологии получения алюминия.
Соли натрия и серной кислоты встречаются в природе в виде двух типов - водные и безводные. Залежи водной формы сульфата натрия Na2SО4⋅12H2О в виде бесцветных кристаллов имеются в СССР, Мексике, Аргентине. Этот минерал называется мирабилитом, а Na2Sp4⋅ 10Н2О - глауберовой солью. Встречается и безводная форма - тенардит Na2SО4- В XIX в. большие количества сульфата натрия стали применять для получения соды (по Леблану), а также для изготовления краски - ультрамарина и в текстильной промышленности. Глауберову соль добывали из самосадочных озер, число которых оказалось довольно велико. Мощным источником для получения сульфата натрия является залив Кара-Богаз-Гол.
В начале прошлого века об этом заливе имелись лишь отрывочные сведения. Кара-Богаз значит по-туркменски "черная пасть", залив называли еще "Аджи-Коусар", т. е. "горький колодец" - вода в нем имела горько-соленый вкус. Залив соединяется с Каспийским морем узким проливом, сильное течение в котором направлено от моря внутрь залива. Кара-Богаз-Гол (тогда его называли Карабугазский залив) пользовался дурной славой. Бурное течение делало плавание по проливу настолько опасным, что долгое время морякам вообще не удавалось попасть в залив. О Кара-Богаз-Голе ходили легенды: утверждали, что в середине залива находится "пучина" - отверстие, через которое поток морской воды устремляется в недра земли, при этом обращали внимание на отсутствие видимых стоков, которые могли бы уравновесить постоянный поток воды. Считалось, что поток может засосать корабль, оказавшийся в заливе. В 1719 г. Петр I отправил морских офицеров К. Вердена и Ф. Соймонова с командой солдат в 89 человек и двумя унтер-лейтенантами для исследования берегов Каспийского моря - главным образом западного берега. Восточный был описан по "словесным известиям". Зловещие рассказы о "пучине" и каменистые грунты при входе в залив подействовали на членов экспедиции. И они проехали мимо залива Карабугазский.
Лишь в 1836 г. экспедиции Г. С. Карелина удалось проникнуть в Кара-Богаз-Гол. Несмотря на то, что экспедиция располагала пятью судами, через пролив пришлось идти на шлюпках. Обратный путь был еще более трудным - из-за сильного течения нельзя было пользоваться веслами, пришлось тащить лодки бечевой. Это были первые из русских, ступившие на негостеприимные, страшные берега Карабугазского залива. По данным Карелина, длина залива около 100 верст, ширина - 80. Карелину было известно об отложениях глауберовой соли на дне залива.
В действительности в Кара-Богаз-Голе нет никакой пучины. Интенсивное испарение воды с поверхности мелководного водоема приводит к отложению солей. Длина залива с севера на юг составляет 160 км, ширина с востока на запад - около 150 км, площадь - около 18 000 км2. В средней части залива имеются колоссальные отложения, главным образом водного сульфата натрия. После Великой Октябрьской социалистической революции запасы начали разрабатывать, Установлено, что, кроме сульфата натрия, воды залива богаты хлоридом натрия, солями магния и кальция.
Большой вклад в теорию и практику получения солей внес выдающийся советский ученый академик Н. С. Курнаков, его ученики и сотрудники. Ими было доказано, что мирабилит осаждается в осенне-зимний период, а весной и летом он растворяется. Курнаков изучил равновесие между солями:
2NaCl+MgSО4⇔Na2SО4+MgCl2
Сдвиг этого равновесия вправо ведет к перенасыщению раствора сульфатом натрия и его кристаллизации.
В. И. Ленин в 1918 г. отметил значение Кара-Богаз-Гола для промышленности нашей страны в своей работе "Очередные задачи Советской власти". С 1939 г. в Кара-Богаз-Голе организована промышленная добыча мирабилита. Вода залива подвергается медленному испарению в бассейнах, и в зимнее время из нее кристаллизуется водный сульфат натрия. В случае одновременной кристаллизации хлорида натрия добавляют морскую воду, регулируя режим испарения так, чтобы выделялся чистый мирабилит. Теоретическое исследование условий выделения отдельных солей из раствора, содержащего их смесь, представляет трудную и важную для производства задачу. Пришлось создать новую науку - галургию- науку о солях, позволяющую управлять процессом выделения солей из растворов при изменении внешних условий.
К списку важнейших минералов, содержащих натрий, прибавим еще буру Na2B4О7·10Н2О- соль тетраборной кислоты, отложения которой имеются в нашей стране. Этот минерал является источником получения бора и важен для целого ряда отраслей техники. Натрий входит в состав многих силикатных минералов, например лазурита Na2[AlSi3О18]·2H20, альбита Na[AlSi3О8] и др.
Криолит - буквально "холодный камень" (по гречески "криос" - холод, "литое" - камень) - минерал белого или серого цвета со стеклянным блеском; его находили в Гренландии в Ивигтуте. По составу - это комплексное соединение Na3AlF6. Схематически можно представить его строение следующим образом: ион алюминия не имеет внешних электронов, ион фтора на внешней оболочке имеет 8 электронов, т. е. четыре пары. Шесть ионов фтора, окружая ион алюминия, создают вокруг него 12-электронную оболочку. Заряд такого комплекса равен -3(+ 3-6=-3). За счет этого заряда и удерживаются три положительно заряженных иона натрия Na+:
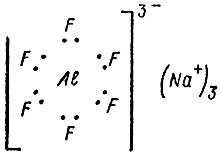
Следовательно, криолит - это соль, в которой катионами являются три иона натрия, а анионом - группа A1F63-. Криолит сначала добывали в Гренландии - это единственное месторождение минерала, а затем начали получать искусственным путем из фторидов натрия и алюминия. Причина, по которой возникла в промышленности потребность в этом редком минерале, заключается в том, что его использовали для получения алюминия. Роль алюминия в технике исключительно велика, но извлечение его из соединений (оксидов, которые встречаются в природе в виде минерала боксита). химическим путем сложно и дорого. Успех в производстве алюминия был достигнут, когда его стали выделять посредством электролиза из расплавленных соединений. Однако оксид алюминия плавится лишь при очень высокой температуре. Если же растворить оксид р расплавленном, криолите, то можно снизить температуру электролиза и вести процесс получения алюминия экономически и технически выгодным способом. Криолит применяют также и в других производствах, например для получения эмалей. Первооткрыватель натрия и калия Г. Дэви первый установил, что оба эти металла очень активны в химических реакциях - они разлагают воду с выделением водорода, разлагают аммиак и сероводородную кислоту"
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'