
Соединений меди (II)
Оксиды и гидроксиды. Оксид меди (II) СuО - порошок черного цвета, устойчив при низких температурах, практически не растворимый в воде. Это соединение можно получить несколькими способами: нагреванием меди, термическим разложением ее нитрата или основного карбоната, а также нагреванием водной суспензии Сu(ОН)2 при 50°С:
Сu(NО3)2 = СuО + 2N2 + 1/2О2
CuCO3·Cu(OH)2 = 2CuO + H2О + CО2
Cu(OH)2 = CuO + H2О
При нагревании СuО растворяется в концентрированной соляной кислоте:
CuO + HCl = CuCl2 + H2О
Оксид меди (II) при высоких температурах (~300°С) легко восстанавливается водородом, углеродом, углеводородами и еще целым рядом восстановителей. В результате получается медь (рис. 18):
2CuO + C = 2Cu + CО2
CuO + H2 = Cu + H2О
CuO + СН3ОН = Сu + Н2О + СН2О
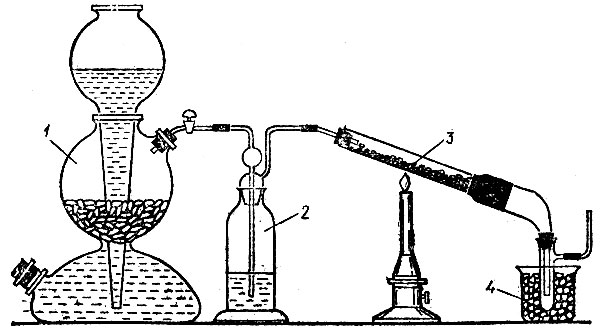
Рис. 18. Получение меди восстановлением водородом оксида меди (II): 1 - аппарат Киппа с водородом, 2 - склянка Дрекселя с концентрированной серной кислотой, 3 - тугоплавкая трубка с оксидом меди (II), 4 - приемник для воды
Последнюю реакцию можно наблюдать, если нагреть на горелке пластинку и ту часть ее, что почернела в результате окисления, не дав остыть, опустить в спирт. Способность СuО восстанавливаться используется в микроанализе для определения углерода, водорода и азота в органических соединениях. В качестве окрашивающего пигмента оксид меди (II) находит применение в стекольной промышленности, так как СuО, растворяясь в стекле, придает ему зеленовато-свдюю окраску.
Если на растворы солей меди (II) на холоде подействовать щелочами, то образуется студнеобразный голубой осадок - гидроксид меди:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
На холоде реакцию ведут потому, что при нагревании Сu(ОН)2 разлагается. Гидроксид меди (II) -плохо растворимое в воде вещество, которое является слабым основанием и обладает в небольшой степени амфотерными свойствами. Взаимодействуя с кислотами, оно образует соли, а с концентрированными щелочами - ярко-синие растворы гидроксокупратов:
Cu(OH)2 + 2NaOH = Na2[Cu(OH)4]
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'