
Лабораторные опыты
Общие свойства полимеров
1. Отношение к нагреванию. В фарфоровых чашечках или на асбестовой сетке нагрейте несильно кусочки полимеров, например полиэтилена, полихлорвинила, органического стекла, фенолформальдегидной пластмассы, резины. Прикасаясь к образцам стеклянной палочкой или лучинкой, убедитесь, что одни из них постепенно размягчаются, затем они переходят в вязко-текучее состояние. Другие же не размягчаются, а при более сильном нагревании разлагаются.
Запишите изменения, происходящие с каждым из образцов. Что можно сказать о структуре этих полимеров?
2. Отношение к растворителям*. Налейте каждого из имеющихся в лаборатории растворителей - бензола, бензина, ацетона, дихлорэтана, четыреххлористого углерода - в две отдельные пробирки по 2-3 мл. В растворители поместите по очень небольшому количеству различных полимеров в мелко измельченном состоянии (в виде гранул, крошки, стружек и т. п.). В одну пробирку с бензолом поместите полиэтилен, в другую пробирку с этим же растворителем - полистирол; в пробирки с бензином поместите резину и фенолформальдегидную пластмассу; в пробирки с ацетоном - органическое стекло и резину; в пробирки с дихлорэтаном - полистирол и органическое стекло и т. д. Встряхивая временами содержимое пробирок, наблюдайте в течение 10-15 минут растворение одних полимеров (о чем можно судить по уменьшению количества полимера и образованию вязкого раствора), набухание других, нерастворимость третьих. Пробирки, где незаметно изменений, подогрейте и наблюдайте, происходит ли изменение в этом случае.
*(По указанию учителя выполнение опыта может быть распределено между несколькими учащимися.)
Отметьте, какие изменения происходят с каждым полимером при действии на него соответствующих растворителей.
Как поведение данных полимеров связано с их структурой?
Полиэтилен
3. Удельный вес. Образец полиэтилена (гранулы, кусочек пленки, пластинку, пробку от бутылки и т. п.) поместите в стакан с водой. Наблюдайте, тонет ли полимер в воде.
Что можно сказать об удельном весе полиэтилена на основании опыта?
4. Электропроводность. К пленке или пластинке из полиэтилена приложите (с обеих сторон) электроды от источника тока со включенной в цепь последовательно электрической лампочкой. Для сравнения таким же способом испытайте металлический предмет.
Является ли полиэтилен проводником электрического тока?
5. Отношение к нагреванию. Пользуясь держателем, нагрейте несильно образец полиэтилена над пламенем спиртовки или горелки. Наблюдайте постепенное размягчение полимера и затем оплавление его. Стеклянной или деревянной палочкой измените форму размягченного полиэтилена и дайте ему остыть. Попытайтесь изменить форму образца при обычной температуре.
Какое свойство полиэтилена лежит в основе наблюдаемых явлений? При каких условиях это свойство проявляется? Какое практическое значение оно имеет?
6. Сварка полиэтилена. Наложите одну полиэтиленовую пленку на край другой такой же пленки, покройте их листом бумаги и проведите несколько раз по бумаге над местом соединения пленок нагретой стеклянной палочкой.
Что произошло с пленками? Проверьте прочность полученного шва.
7. Горение. Образец полиэтилена подожгите в пламени спиртовки (горелки). Обратите внимание, быстро ли загорается полиэтилен, горит ли он вне пламени, какого цвета его пламя, образуется ли при горении копоть.
Запишите результаты наблюдений.
8. Отношение к бромной воде и раствору марганцовокислого калия. В пробирки с бромной водой и раствором марганцовокислого калия поместите гранулы или мелкие кусочки полиэтилена. Наблюдайте, происходит ли изменение окраски растворов.
Сравните отношение этилена и полиэтилена к действию бромной воды и окислителя. Можно ли полиэтилен считать непредельным соединением?
9. Отношение к кислотам и щелочам. В пробирки с концентрированными растворами серной кислоты, азотной кислоты и щелочи поместите измельченные кусочки полиэтилена. Наблюдайте, действуют ли эти вещества на полимер. Затем пробирку с серной кислотой и полиэтиленом нагрейте до появления признаков химической реакции.
Реагирует ли полиэтилен с кислотами и щелочами при обычной температуре? Какие изменения происходят с полиэтиленом под действием кислоты при нагревании? Какой вывод о химических свойствах полимера можно сделать на основании проведенных опытов?
Полихлорвинил
10. Удельный вес. Кусочки полихлорвинила (винипласта или пластиката) поместите в стакан с водой.
Легче или тяжелее воды данный полимер?
11. Горение. Подожгите маленький кусочек полихлорвинила (пленки, электроизоляция и т. п.), наблюдайте характер горения, затем удалите горящий образец из пламени. Повторите опыт еще раз.
Чем сопровождается горение полихлорвинила? Горит ли полимер вне пламени?
12. Отношение к нагреванию. Кусочки полимера (лучше всего винипласта как более твердого материала) нагрейте несильно в пробирке или фарфоровой чашечке. Проверьте стеклянной палочкой, происходит ли размягчение и изменение формы полимера. Усильте нагревание до разложения полимера. К выделяющимся газообразным продуктам разложения поднесите влажную синюю лакмусовую бумажку и затем палочку, смоченную крепким раствором аммиака, наблюдайте происходящие явления.
Проявляет ли полихлорвинил свойство термопластичности? Какой газообразный продукт вы обнаружили при разложении полихлорвинила?
Вариант опыта. Кусочки полихлорвинила нагрейте в пробирке, закрытой пробкой с отводной трубкой. Газообразные продукты разложения пропустите в пробирку с небольшим количеством воды. К полученному водному раствору прилейте несколько капель раствора азотнокислого серебра и 1-2 капли азотной кислоты.
О выделении какого вещества при разложении полихлорвинила свидетельствует появление осадка в пробирке? Составьте уравнение реакции образования вещества, выпадающего в осадок.
13. Отношение к кислотам, щелочи и окислителям. Поместите небольшие кусочки полихлорвинила в пробирки с крепкими растворами серной (или азотной) кислоты, щелочи, марганцовокислого калия. Наблюдайте, происходят ли химические реакции.
Какой вывод о химических свойствах полимера можно сделать на основании опыта?
Полистирол
14. Хрупкость полистирола. При помощи плоскогубцев или другого приспособления разломайте кусочки разбитого изделия из полистирола (блюда, розетки, детской игрушки и т. п.) на более мелкие частички. Хрупкость полимера можно наблюдать также, если по кусочкам полистирола ударять молотком.
15. Растворимость. В пробирку с 2-3 мл бензола или дихлорэтана поместите измельченные кусочки полистирола. Наблюдайте при встряхивании пробирки происходящие изменения с полимером. Смажьте полученным вязким раствором концы пластинок полистирола и, положив их одна на другую, сдавите пальцами или поместите под груз. Через некоторое время пластинки оказываются склеенными.
16. Отношение к нагреванию. Нагрейте несильно кусочек полистирола над пламенем горелки или на асбестовой сетке. Проверьте, легко ли он изменяет форму, сохраняет ли приданную форму после охлаждения.
Сравните по термопласгичности полистирол с предыдущими полимерами.
Вариант опыта. Тонкий кусочек полистирола опустите в воду, нагретую до кипения. Наблюдайте, размягчается ли полистирол при этих условиях. Для сравнения таким же способом испытайте полиэтилен.
Что можно сказать о теплостойкости полистирола на основании данного опыта?
17. Горение. Подожгите кусочек полистирола. Проверьте, горит ли он вне пламени, образуется ли при этом копоть, обладают ли продукты горения запахом. Запишите результаты наблюдения.
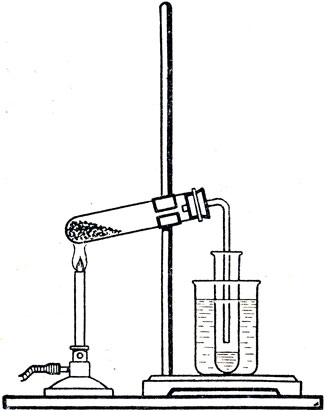
Рис. 20. Деполимеризация полистирола
18. Разложение при нагревании (деполимеризация). Мелкие кусочки неокрашенного полистирола поместите в пробирку и соберите прибор, как показано на рисунке 20. Нагревайте пробирку постепенно на голом пламени. Наблюдайте за изменениями полистирола. Образующийся при разложении полимера стирол конденсируется в приемнике - пробирке, охлаждаемой водой. Примесями он окрашен в желтый цвет. Опыт не следует доводить до разложения всего полимера, так как при этом образуется много побочных продуктов. При наличии времени полученный стирол перегоните вторично (из другой пробирки) с целью его очистки. Для более ровного кипения жидкости поместите в пробирку очень немного чистого речного песку; перегонку и в этом случае не доводите до конца. Испытайте полученный стирол бромной водой и раствором марганцовокислого калия.
Составьте уравнения деполимеризации полистирола и взаимодействия стирола с бромной водой.
19. Полимеризация стирола. Налейте в чистую пробирку 2-3 мл стирола, прибавьте туда несколько крупинок перекиси бензоила в качестве инициатора реакции (требуется 0,01-0,03 г) и соберите прибор, как показано на рисунке 21. Нагревайте пробирку через асбестированную сетку так, чтобы только поддерживалось очень слабое кипение жидкости. Наблюдайте постепенное повышение вязкости ее вследствие полимеризации. Минут через 10-12, когда жидкость примет консистенцию густого сиропа, нагревание можно прекратить. Чтобы получить полимер в твердом виде, следует продолжить нагревание пробирки на водяной бане (в стакане с кипящей водой). Однако для этого может не хватить времени на уроке, так как дальнейшая полимеризация идет довольно медленно. Если будет получен твердый полимер, разбейте пробирку (предварительно обернув ее куском ткани) и извлеките стерженек полистирола.
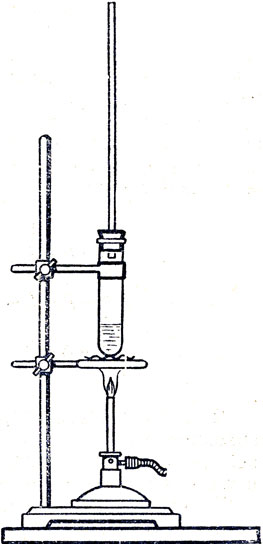
Рис. 21. Полимеризация стирола
Составьте уравнение реакции полимеризации стирола.
Полиметилметакрилат
20. Растворимость. Пользуясь в качестве растворителя ацетоном или дихлорэтаном, опыт проведите, как описано" для полистирола. Полиметилметакрилат может быть взят в виде стружки или мелких кусочков органического стекла.
21. Отношение к нагреванию. Установите опытным путем, является ли данный полимер термопластичным.
22. Горение. Подожгите кусочек полиметилметакрилата. Проверьте, горит ли полимер вне пламени, выделяется ли при горении копоть, какой окраски пламя. Обратите внимание на слабое потрескивание при горении и образующийся запах.
Сделайте обобщение, как по горению можно распознать полиметилметакрилат, полистирол, полихлорвинил и полиэтилен.
23. Разложение при нагревании. Опыт поставьте, как описано для полистирола. Деполимеризация полиметилметакрилата идет легче, мономер образуется более чистым и с большим выходом. Если метилметакрилат получился достаточно чистым, повторную перегонку его можно не производить. Проверьте отношение мономера к бромной воде и раствору марганцовокислого калия.
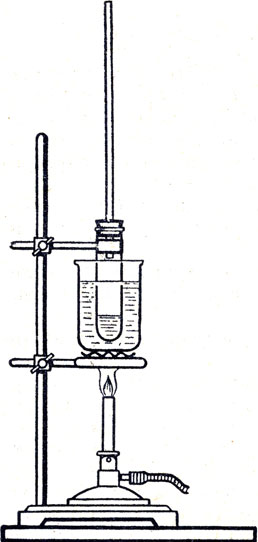
Рис. 22. Полимеризация метил-метакрилата
Составьте уравнение деполимеризации полиметилметакрилата.
24. Полимеризация метилметакрилата. Полимеризация данного мономера происходит легче, чем стирола, и может быть проведена при более низкой температуре (на водяной бане) с образованием твердого продукта.
Налейте в чистую пробирку 2-3 мл метилового эфира метакриловой кислоты, прибавьте несколько мелких крупинок перекиси бензоила (0,01-0,03 г), закройте пробирку пробкой с длинной вертикальной трубкой в качестве воздушного холодильника и нагревайте на водяной бане (рис. 22) при температуре около точки кипения воды (90-95°). Через некоторое время жидкость в пробирке начинает густеть и минут через 15-20 почти затвер девает. Охладите пробирку, разбейте ее (обернув предварительно куском ткани) и извлеките стерженек полимера.
Составьте уравнение полимеризации метилметакрилата.
Фенолформальдегидные пластмассы
.. 25. Отношение к нагреванию. Нагрейте в пробирке или в фарфоровой чашечке кусочки бросовых деталей из фенолформальдегидной пластмассы (штепсельных розеток, выключателей и т. п.) до их химического разложения. Проверьте, происходит ли при этом предварительное размягчение пластмассы.
Являются ли термопластичными фенолформальдегидные пластмассы? Что можно сказать о структуре данного полимера?
26. Горение. Подожгите кусочек пластмассы и исследуйте характер горения, как это делалось по отношению к другим полимерам.
Что можно сказать о горючести фенолформальдегидной пластмассы?
27. Синтез фенолформальдегидной смолы. В пробирку поместите 2 г кристаллического фенола, 3 мл 40-процентного формалина и около 0,1 мл (несколько капель) концентрированной соляной кислоты в качестве катализатора. Пробирку закройте пробкой с длинной вертикальной трубкой и нагрейте осторожно в вытяжном шкафу (!) на небольшом пламени. Вскоре смесь становится однородной, затем она вскипает вследствие проходящей в ней реакции и становится мутной. Прекратив нагревание, дайте смеси расслоиться, после чего слейте верхний водный слой и отдельно на лист бумаги или картона вылейте образовавшуюся смолу. По остывании смола твердеет.
К какому типу реакций относится реакция образования фенолформальдегидной смолы? Составьте уравнение реакции.
Экспериментальные задачи
1. Осуществите "сварку" двух кусочков полихлорвинила.
2. Склейте обломки изделия из полиметилметакрилата, зная, в каких веществах полимер растворяется.
3. При помощи необходимых испытаний распознайте среди выданных образцов: а) полиэтилен, б) полихлорвинил, в) полистирол, г) полиметилметакрилат, д) фенолформальдегидную пластмассу.
Волокно хлорин
28. Растворимость. В пробирку с 2-3 мл ацетона поместите небольшой пучок хлоринового волокна. Содержимое пробирки взбалтывайте до растворения полимера. Прилейте к раствору воду, наблюдайте происходящие изменения.
Как объяснить образование осадка при прибавлении воды к раствору хлорина в ацетоне? Какое производственное значение имеют процессы, воспроизведенные в данном опыте?
29. Отношение к нагреванию. Кусочек ткани из хлорина или пучок волокна нагрейте в пробирке или фарфоровой чашечке. Отметьте, быстро ли наступают изменения с хлорином. Продолжайте нагревание до разложения полимера. Обратите внимание на запах продуктов разложения.
Что можно сказать о теплостойкости хлорина на основании проведенного опыта? Какое газообразное вещество обнаруживается по запаху в продуктах разложения хлорина? Сравните хлорин и. полихлорвинил по отношению к нагреванию.
30. Отношение к кислотам и щелочам. Поместите волокно в пробирки с концентрированными растворами серной кислоты и щелочи. Наблюдайте, происходят ли с ним изменения. Затем проверьте, произойдут ли изменения с волокном при нагревании кислоты и щелочи.
О каком химическом свойстве хлорина свидетельствуют результаты опыта? Чем объясняется это свойство полимера?
Волокно капрон
31. Отношение к нагреванию. Нагрейте в пробирке или фарфоровой чашечке кусочек капроновой смолы или свернутые в плотный комочек обрывки трикотажного изделия из капрона. Наблюдайте, происходит ли размягчение и плавление полимера до его химического разложения.
Обратите внимание на характерный запах продуктов разложения.
К термопластичным или термореактивным полимерам относится капрон? Какое практическое значение имеет свойство, наблюдавшееся в опыте?
32. "Формование" волокна. Взяв образец капрона в щипцы или держалку для пробирок, нагрейте его слегка над пламенем.
Когда капрон начнет размягчаться и сделается вязким (не нагревать до плавления), прикоснитесь к нему лучинкой или стеклянной палочкой. Отводя затем быстро палочку от капрона, вытяните тонкую нить. Опыт повторите несколько раз.
33. Отношение к кислотам и щелочам. Поместите кусочки капрона в пробирки с растворами серной кислоты и щелочи. Наблюдайте, какой из реактивов действует на полимер.
Что можно сказать о химической стойкости капрона по сравнению с хлорином, полиэтиленом и полистиролом?
Экспериментальные задачи
4. Испытайте горючесть хлоринового и капронового волокон.
5. Обнаружьте химическим способом: а) хлористый водород, б) хлор в продуктах разложения хлорина.
6. Пользуясь различными признаками, распознайте среди выданных волокон: а) шерстяное, б) хлопчатобумажное, в) хлориновое, г) капроновое.
Каучук и резина
34. Отношение к растворителям. В пробирку с 3-4 мл бензина или бензола поместите кусочки невулканизированного каучука; в другую пробирку с этим же растворителем поместите такие же кусочки резины (например, от резиновой пробки или трубки). Пробирки закройте корковыми пробками и оставьте до конца урока или лучше до следующего занятия. Наблюдайте различное действие растворителя на каучук и резину.
Чем объясняется, что каучук в бензине (бензоле) растворяется, а резина в нем только набухает?
35. Взаимодействие каучука с бромом. К раствору натурального или синтетического каучука в бензоле или бензине (очищенном предварительно от примеси непредельных углеводородов) прилейте бромную воду и смесь сильно встряхивайте.
Что можно сказать о строении каучука на основании результатов опыта? Для иллюстрации ответа приведите строение элементарного звена какого-либо каучука. Составьте уравнение реакции каучука с бромом.
36. Открытие серы в резине. Нагрейте в пробирке несколько кусочков резины. В выделяющиеся при разложении ее пары поместите бумажку, смоченную раствором азотнокислого свинца Pb(NO3)2 или уксуснокислого свинца Pb(C2H3O2)2. Наблюдайте изменение цвета бумажки под действием сероводорода, образующегося при разложении резины.
В какой цвет окрашивается свинцовая бумажка? Составьте уравнение происходящей при этом реакции. Назовите окрашенное вещество. Какую роль в резине играет сера?
Экспериментальные задачи
7. Проведите реакцию разложения каучука при нагревании, подобно тому как ставились опыты деполимеризации. Докажите наличие непредельных соединений в продуктах его разложения.
8. Сравните эластичность и прочность на разрыв каучука и резины, взятых в виде небольших лент одинакового сечения.
9. Нагрейте в кипящей воде одинаковые по размерам образцы каучука и резины и сравните пластичность этих материалов при повышенной температуре.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'