
Атом
В переводе с греческого слово "атом" означает "неделимый". На протяжении многих столетий атом считали пределом делимости материи. В XIX в. ученые уже могли определить относительные атомные массы химических элементов, хотя никто из них не знал, как устроен атом.
С развитием естественных наук изменилось содержание понятия "атом". Представление о его неделимости опровергнуто раз и навсегда. Его можно "разобрать" на "составные части" - ядро и электронную оболочку. Постепенно отрывая электрон за электроном, можно получать ионы все более высоко-то заряда. С помощью ядерных реакций атом одного элемента можно превратить в атом другого или других элементов. Атом оказался изменчивым и делимым, но само понятие сохранилось и, видимо, сохранится в науке. По современным представлениям, атом - мельчайшая частица химического элемента.
На фоне многих других материальных образований природы атом представляет структуру во многих отношениях уникальную. Он построен из трех видов элементарных частиц - протонов, нейтронов и электронов. В целом такая система весьма устойчива. Протон и нейтрон входят в состав атомного ядра, электроны образуют электронную оболочку. Силы, управляющие поведением ядра и электронов, принципиально различны. В ядре действуют так называемые ядерные силы, проявляющиеся лишь на очень коротких расстояниях, порядка 10-12 см. Благодаря ядерным силам совокупность положительных протонов и не имеющих заряда нейтронов образует в ядре прочную систему. Взаимодействие отрицательных электронов с ядром и друг с другом подчиняется кулоновским силам притяжения и отталкивания. Число протонов в ядре равно числу электронов в оболочке, и потому атом электрически нейтрален.
Линейные размеры атома в среднем достигают 10-8 см, а ядра 10-12 см. Средний объем ядра 10-36 см3, незначителен по сравнению с объемом атома (10-24 см3). Таким образом, атом представляет довольно-таки "прозрачную" структуру. Но поскольку электроны способны перемещаться во всех направлениях относительно ядра, постоянно заполняют все пространство атома ("размазаны" в этом пространстве), то атомы в конечном счете выглядят твердыми материальными образованиями.
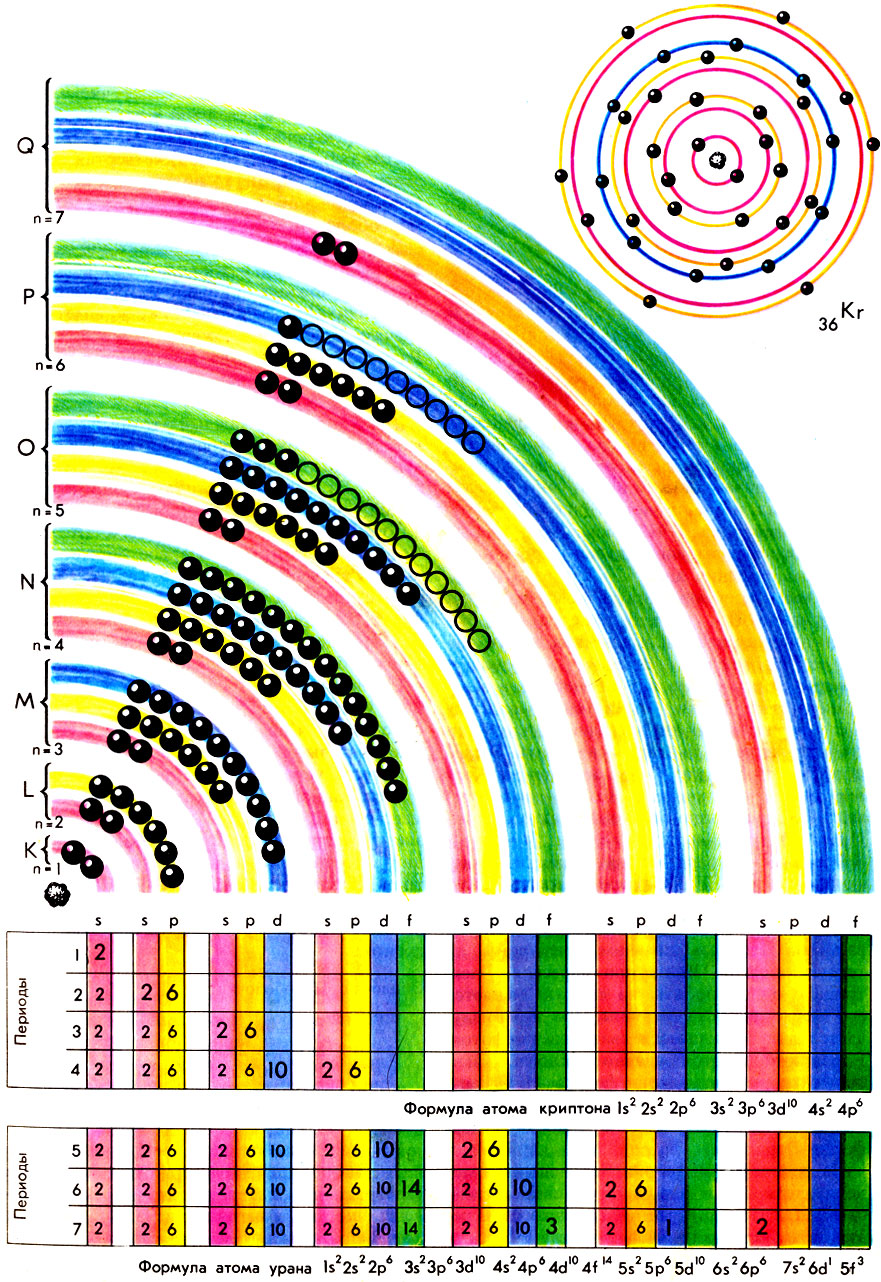
Структура атомов урана и криптона
В настоящее время создана строгая физическая теория строения атомов, ученые научились проводить эксперименты с единичными атомами химических элементов. С помощью специальных электронных микроскопов удалось "разглядеть" и даже сфотографировать отдельные атомы. А между тем менее ста лет назад атом был полной загадкой, а его строение - лишь плодом умозрительных заключений.
Лишь когда был открыт электрон (1897), возникли предположения, что именно из электронов состоят все атомы. Появилось несколько моделей "электронного" строения атомов. Но они не давали ответа на кардинальный вопрос: что же служит носителем положительного электричества в атоме? Ведь атом в целом электронейтрален.
Современную модель строения атома предложил в 1911 г. Э. Резерфорд. Она получила название ядерной, или планетарной. По Резерфорду, в центре атома находится положительно заряженное ядро. В нем сосредоточена почти вся масса атома. Вокруг ядра, подобно планетам вокруг Солнца, вращаются электроны. Ученые не сразу смогли сделать определенный вывод о том, как устроено ядро. Сначала полагали, что оно состоит из протонов и электронов. Только после открытия нейтрона (1932) советский ученый Д.Д. Иваненко выдвинул идею о протон-нейтронном строении ядра.
Модель Резерфорда наука сразу взяла на вооружение. Но у нее был недостаток, настолько существенный, что ставил под сомнение ее правомерность. Вращаясь вокруг ядра, электроны постоянно теряли энергию и в конечном счете должны были упасть на ядро. Так утверждали законы классической механики, а их никто не пытался оспаривать. Таким образом, любой атом рано или поздно был обречен на уничтожение. Но это противоречило представлению об атомах как об устойчивых материальных структурах.
Решение этой задачи нашел известный датский физик Н. Бор. Он предположил: электроны движутся в атомах не по любым орбитам, а лишь по определенным, квантованным. Двигаясь по ним, электроны не теряют энергии. Лишь при перескоке электрона с одной орбиты на другую меняется его энергетическое состояние. При этом излучается или поглощается квант света - фотон. Бор, таким образом, удачно приложил квантовую теорию немецкого физика М. Планка к модели атома Резерфорда, и потому правильно называть эту модель моделью Резерфорда Бора.
На основе своей теории Бор построил модели атомов всех элементов и связал свойства элементов со строением их атомов. В результате была найдена физическая сущность явления периодического изменения свойств химических элементов и разработана теория их периодической системы.
Электроны, движущиеся вокруг атома, группируются в оболочки. Каждая оболочка имеет конечную емкость, так как может содержать строго определенное число электронов: первая, ближайшая к ядру K - оболочка - 2 электрона; вторая (L) - 8 электронов; третья (М) - 18 электронов; четвертая (N) - 32 электрона и т.д. Легко подсчитать, что числа электронов в оболочках равны 2n2, где n - номер оболочки.
В свою очередь, электроны каждой оболочки группируются в подоболочки, причем число возможных подоболочек равно номеру оболочки. Подоболочки также принято обозначать латинскими буквами s, р, d, f, g и др. Разумеется, количества электронов в подоболочках ограниченны: они равны соответственно 2, 6, 10, 14, 18.
Таким образом, каждый атомный электрон может быть охарактеризован своей принадлежностью к той или иной оболочке и подоболочке. Эта принадлежность определяется двумя величинами, которые называются главным (n) и орбитальным (l) квантовыми числами. Первое может принимать значения 1, 2, 3, 4, 5, 6, 7 (т.е. совпадает с номером оболочки), второе - значения 0, 1,2, 3..., причем l всегда меньше n. Между n и l существует простая связь: при n = 1 l может быть равно только 0; при n = 2 l = 0 и 1; при n = 3 l = 0,1 и 2; при n = 4 l = 0, 1, 2 и 3 и т. д. Числа электронов в подоболочках определяются по простой формуле 2(2l + 1). Следовательно, два квантовых числа (n и l) характеризуют положение данного электрона в электронной конфигурации атома. Например, если n = 3, l = 2, то это значит, что электрон принадлежит к М - оболочке и входит в состав ее d-подоболочки; такой электрон обозначается символом 3d.
Соотношения между оболочками и подоболочками просто иллюстрируются следующей схемой:
Оболочки: Подоболочки:
К(n = 1) 1s(l = 0) L(n = 2) 2s(l = 0) 2р(l = 1) М(n = 3) 3s(l = 0) Зр(l = 1) 3d(l = 2) N(n = 4) 4s(l = 0) 4p(l = 1) 4d(l = 2) 4f(l = 3) и т.д.
Но оказалось, что двух квантовых чисел - n и l-для полной характеристики состояния электрона в атоме недостаточно. Были введены еще два квантовых числа. Одно из них получило название магнитного (ml). Оно связано с наличием у электрона магнитного момента. При данном l оно может принимать (2l + 1) значений - от - l до + l. Например, для l = 2 набор значений ml следующий - 2, -1, 0, +1, +2. Другое новое квантовое число получило название спинового (от англ. spin - "вращаться"). Оно может принимать лишь два значения: + ½ и - ½ и характеризует вращение электрона вокруг собственной оси. Все же другие квантовые числа (главное, орбитальное, магнитное) определяют специфику движения электрона вокруг ядра.
В 1925 г. швейцарский физик В. Паули сформулировал правило, носящее название принципа Паули: в атоме не может быть двух электронов, характеризующихся одинаковыми значениями четырех квантовых чисел. Этот принцип и позволил четко объяснить емкость электронных оболочек и подоболочек: Nl (число электронов в подоболочках) = 2 (2l + 1), а Nn (число электронов в оболочке)
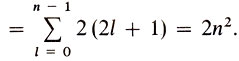
В каком порядке происходит заполнение электронных оболочек и подоболочек атомов? Казалось бы, наиболее простой и логичный вариант следующий: по мере роста заряда ядра Z последовательно до полной емкости заполняются электронные оболочки, согласно увеличивающимся значения главных квантовых чисел.
Иными словами, записанная на "электронном" языке схема заполнения должна была бы выглядеть так:
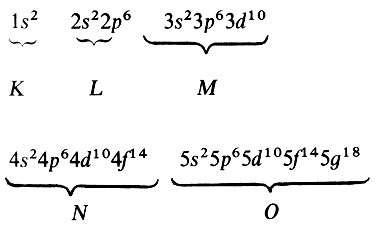
Но в действительности наблюдается другая картина. Только К- и L-оболочки заполняются сразу и до полной емкости. Заполнение М-оболочки происходит в два приема: сначала заполняются 3s- и 3р - подоболочки, затем в атоме появляются 4s - электроны, и только вслед за этим начинается построение 3d - подоболочки. Подобное ступенчатое заполнение оболочек является фундаментальным законом построения электронных конфигураций атомов по мере роста Z. Изображенная выше схема их построения называется идеальной, тогда как на самом деле выполняется реальная схема заполнения оболочек и подоболочек:
ls22s22p63s23p64s23d104p65s24d105p66s24f145d106p67s25f14
Следствием реальной схемы оказывается структура периодической системы химических элементов.

Изображение атомов урана (светлые пятна) на тонкой подложке из углерода (при увеличении в 7,5 млн. раз). Микрофотография получена с помощью микроскопа с атомным разрешением
Почему природа отдала предпочтение реальной схеме перед идеальной? Однозначного строго обоснованного объяснения, пожалуй, нет до сих пор. Правда, более или менее удовлетворительный ответ был найден, когда к объяснению модели атома были применены представления квантовой механики.
В основе квантовой механики лежит идея, что электрон наряду с материальными свойствами обладает и волновыми, т.е. он одновременно является и частицей, и волной. Поэтому его поведение в атоме может быть описано с помощью волнового уравнения, которое вывел в 1926 г. австрийский физик Э. Шредингер. Математики называют его дифференциальным уравнением второго порядка в частных производных:
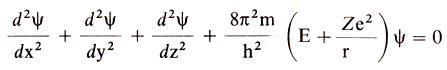
Почти все величины, входящие в уравнение, вам знакомы. Так, m - масса электрона, е - его заряд, r - расстояние от ядра, Е- полная энергия электрона, равная сумме кинетической и потенциальной энергий. Наконец, Z - заряд ядра атома (равный 1 для водорода). Нет нужды объяснять, что такое π. Буквами х, у и z обозначаются координаты электрона. Входит в уравнение также и величина h-постоянная Планка.
Что же касается величины ψ, то она представляет собой так называемую волновую функцию. Она не измеряется ни в граммах, ни в сантиметрах, ни в секундах. Это отвлеченная величина, характеризующая степень вероятности того, что данный электрон находится в определенном участке пространства, окружающего ядро. Если ψ = 1, то, значит, электрон располагается на некотором определенном месте; если же ψ = 0, то, следовательно, в этом месте электрона нет. Представление о вероятности нахождения электрона на данном участке околоядерного пространства является главным в квантовомеханической модели атома.
Поэтому в такой модели нет определенных электронных орбит, столь четко очерченных Бором в его модели атома. Электроны как бы размазаны в пространстве в виде некоторого электронного облака. Большей плотности облака соответствует большая вероятность нахождения электрона.
Хотя квантовомеханическая модель атома сложна, но она лежит в основе современных теорий химической связи, являясь их строгой физической основой. С другой стороны, решение уравнения Шредингера позволяет вывести последовательность формирования электронных конфигураций атомов по мере роста Z. Оказывается, волновая функция связана с тремя величинами, которые могут принимать только целочисленные значения. И эти величины не что иное, как главное, орбитальное и магнитное квантовые числа.
Но все это означает, что решение уравнения Шредингера в конечном счете позволяет теоретически вывести реальную схему формирования электронных конфигураций атомов по мере роста Z. Правда, это далеко не так просто. Ведь уравнение Шредингера имеет точное решение только для атома водорода - простейшего из атомов. Уже для атома гелия его нельзя решить точно: здесь добавляется сила взаимодействия между электронами. И учесть это чрезвычайно сложно математически. На помощь приходят быстродействующие электронные вычислительные машины, производящие сотни тысяч операций в секунду. Да и то при условии, что программа для вычислений разрабатывается с упрощениями и приближениями.
Преимущество квантовомеханической модели атома перед моделью Бора в том, что она основана на строгих физических закономерностях. Но и модель Бора не утратила своего значения, ведь именно ею пользуются до сих пор при объяснении основных закономерностей периодического изменения свойств химических элементов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'