
В
Валентность
Валентность - свойство атома или группы атомов соединяться с определенным числом других атомов. Величина валентности определяется числом атомов водорода или другого одновалентного элемента, с которыми соединяется атом данного элемента. Так, в НС1 хлор одновалентен, в Н2O кислород двухвалентен, в NH3 азот трехвалентен, в СН4 углерод четырехвалентен, в РСl5 фосфор пятивалентен, в SCl6 сера шестивалентна, в ReF7 рений семивалентен, в RuO4 рутений восьмивалентен, в H2SO4 группа атомов SO4 двухвалентна.
Применяется также термин стехиометрическая валентность, которая определяется соотношением:
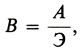
где В - валентность элемента (атома), А - молярная масса атомов в г/моль, Э - эквивалентная масса в г/моль. Так, стехиометрическая валентность углерода в СО равна
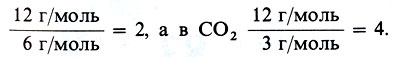
Представление о валентности групп атомов возникло на основе понятия валентности элементов. Например, группа ОН одновалентна, так как она присоединяет одновалентный атом Н (в Н2O) или Na (в NaOH); группа РO4 трехвалентна, поскольку присоединяет 3 атома водорода в Н3РO4 и т.д.
Понятие валентности (атомности) было введено в химию английским химиком Э. Франклендом в 1853 г. Через 5 лет немецкий химик А. Кекуле высказал идею о четырехвалентности атома углерода, что имело важнейшее значение для развития органической химии.
Понять физический смысл валентности помогла электронная теория строения атома и химической связи. С развитием последней изменилось и само это понятие. В настоящее время валентность определяется как число ковалентных связей, которыми данный атом соединен с другими. Число же связей, которые может образовывать атом, равно числу его неспаренных электронов, идущих на образование общих электронных пар (молекулярных двухэлектронных облаков). Ковалентная связь может образовываться также по донорно - акцепторному механизму. При этом в обоих случаях не учитывается полярность образовавшихся связей, а потому валентность не имеет знака - она не может быть ни положительной, ни отрицательной. Так, например, в молекулах N2 и NH3 азот трехвалентен, так как в них содержится по три общие электронные пары (три связи):

а в аммонии-ионе азот четырехвалентен - содержит четыре общие электронные пары, из них одна, возникшая по донорно - акцепторному механизму (изображена стрелкой):
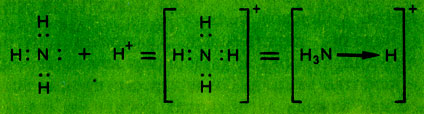
Валентность определяется только числом ковалентных химических связей, в том числе возникших и по донорно-акцепторному механизму. Нельзя говорить о валентности элементов в соединениях, где отсутствуют ковалентные связи: в таких случаях надо говорить о степени окисления.
В неорганической химии во многих случаях понятие валентности элемента теряет определенность: эта величина зависит от знания химического строения соединения, во многих случаях она может быть больше номера группы. В неорганической химии обычно применяется понятие степень окисления, а в органической - валентность, так как большинство неорганических веществ имеют немолекулярное строение, а органических - молекулярное. Нельзя отождествлять эти два понятия, даже если они численно совпадают. Широко применяется также термин валентные электроны, т.е. наиболее слабо связанные с ядром атома, чаще всего внешние электроны.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'