
Водородный показатель
Вода, являясь слабым электролитом (см. Электролиты), в незначительной степени диссоциирует (распадается) на ионы Н+ и ОН-, которые находятся в равновесии с недиссо-циированными молекулами (см. Равновесие химическое):
Н2О → Н+ + ОН- (1)
Равновесную концентрацию ионов обычно обозначают с помощью квадратных скобок [ ] и выражают в молях ионов в 1 л раствора. Как видно из уравнения диссоциации воды (1), в ней концентрации ионов Н+ и ОН- одинаковы. Опытом установлено, что в 1 л воды при комнатной температуре (22°С) диссоциации подвергаются лишь 10-7 моль и при этом образуется 10-7 моль/л ионов Н+ и 10-7 моль/л ионов ОН- (гидроксид-ионов).
Произведение концентраций ионов водорода и гидроксид-ионов в воде называется ионным произведением воды (обозначается Кв). При определенной температуре Кв- величина постоянная. Численное значение его при 22°С равно 10-14:
Kв = [H+][H-] = 10-7 · 10-7 = 10-14 (2)
Постоянство произведения [Н+] [ОН-] означает, что в любом водном растворе ни концентрация ионов водорода, ни концентрация гидроксид-ионов не может быть равна нулю. Иными словами, любой водный раствор кислоты, основания или соли содержит как Н+ ионы, так и гидроксид-ионы ОН-.
Из постоянства произведения [Н+] [ОН-] следует, что при увеличении концентрации одного из ионов воды соответственно уменьшается концентрация другого иона. Это позволяет вычислять концентрацию Н+-ионов, если известна концентрация гидроксид-ионов ОН-, и наоборот. Например, если в водном растворе [Н+] = 10-3 моль/л, то [ОН-] определится так (см. уравнение 2):
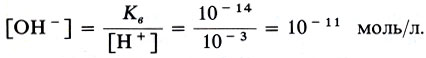
Таким образом, кислотность и щелочность раствора можно выражать через концентрацию либо ионов Н+ , либо ионов ОН-. На практике пользуются первым способом. Тогда для нейтрального раствора [Н+] = 10-7, для кислого [Н+] > 10-7 и для щелочного [Н+] < 10-7 моль/л.
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН (читается "пэ-аш"). Водородным показателем рН называется десятичный логарифм концентрации водородных ионов, взятый с обратным знаком:
pH = - lg [Н+] (3)
или
[Н+] = 10-рН (4)
где [Н+] - концентрация ионов водорода, моль/л.
Понятие "водородный показатель" было введено датским химиком Сёренсеном в 1909 г.: буква "р" - начальная буква датского слова potenz - математическая степень, буква "Н"-символ водорода.
С помощью рН реакция растворов характеризуется так: нейтральная рН 7, кислая рН < 7, щелочная рН > 7. Наглядно зависимость между концентрацией ионов водорода, величиной рН и реакцией раствора можно выразить следующим образом:
чем меньше рН, тем больше концентрация ионов Н+ , т.е. выше кислотность среды; и наоборот, чем больше рН, тем меньше концентрация ионов Н+, т. е. выше щелочность среды.
В качестве примера можно привести значения рН некоторых растворов и указать соответствующую им реакцию среды. Так, у желудочного сока рН 1,7 (сильнокислая реакция), у торфяной воды рН 4 (слабокислая), у дождевой воды рН 6 (слабокислая), у водопроводной воды рН 7,5 (слабощелочная), у крови рН 7,4 (слабощелочная), у слюны рН 6,9 (слабокислая), у слез рН 7 (нейтральная).
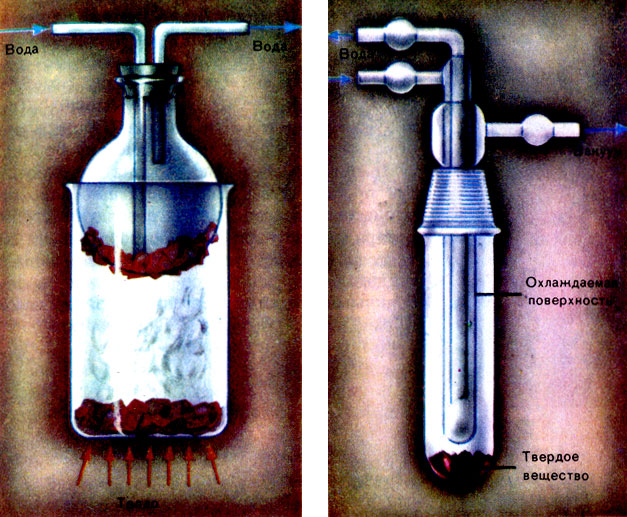
Опыт, позволяющий наблюдать возгонку иода. Слева - при нагревании иод возгоняется, оседая в виде блестящих тонких пластинок. Справа - в охлаждаемой части прибора для возгонки иод конденсируется с образованием кристаллов. Возгонка служит для очистки иода в лабораториях и в промышленности
Исключительно велика роль рН в самых различных явлениях и процессах - и в природе, и в технике. Многие производственные процессы в химической, пищевой, текстильной и других отраслях промышленности протекают лишь при определенной реакции среды. Наш организм нормально функционирует только тогда, когда и в крови, и в тканевых жидкостях важнейших органов поддерживается определенное соотношение Н+ и ОН--ионов (с незначительными колебаниями).
Качественно кислотность или щелочность среды определяют с помощью обычных индикаторов (лакмус, фенолфталеин, метиловый оранжевый). В условиях производства применяют весьма точные инструментальные методы определения рН - с помощью приборов рН-метров.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'