
Изотопы
Изучая явление радиоактивности, ученые в первое десятилетие XX в. открыли большое количество радиоактивных веществ - около 40. Их было значительно больше, чем свободных мест в периодической системе элементов в промежутке между висмутом и ураном. Природа этих веществ вызывала споры. Одни исследователи считали их самостоятельными химическими элементами, но в таком случае оказывался неразрешимым вопрос об их размещении в таблице Менделеева. Другие вообще отказывали им в праве называться элементами в классическом понимании. В 1902 г. английский физик Д. Мартин назвал такие вещества радиоэлементами. По мере их изучения выяснялось, что некоторые радиоэлементы имеют совершенно одинаковые химические свойства, но различаются по величинам атомных масс. Это обстоятельство противоречило основным положениям периодического закона. Разрешил противоречие английский ученый Ф. Содди. В 1913 г. он назвал химически сходные радиоэлементы изотопами (от греческих слов, означающих "одинаковый" и "место"), т.е. занимающими одно и то же место в периодической системе. Радиоэлементы оказались изотопами естественных радиоактивных элементов. Все они объединяются в три радиоактивных семейства, родоначальниками которых являются изотопы тория и урана (см. рис. на с. 232, 234).
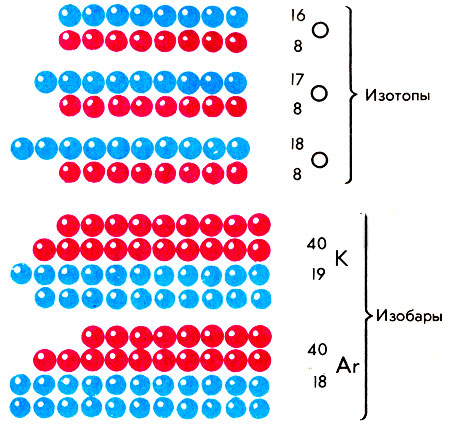
Изотопы кислорода. Изобары калия и аргона (изобары - атомы различных элементов с одинаковым массовым числом)
Вскоре выяснилось, что и у стабильных химических элементов тоже есть изотопы. Основная заслуга в их открытии принадлежит английскому физику Ф. Астону. Он обнаружил стабильные изотопы у многих элементов с помощью специального прибора - масс-спектрометра.
С современной точки зрения, изотопы - это разновидности атомов химического элемента: у них разная атомная масса, но одинаковый заряд ядра Z. Их ядра, таким образом, содержат одинаковое число протонов, но различное число нейтронов. Например, природные изотопы кислорода с Z = 8 содержат в ядрах соответственно 8, 9 и 10 нейтронов. Сумма чисел протонов и нейтронов в ядре изотопа называется массовым числом А. Следовательно, массовые числа указанных изотопов кислорода 16, 17 и 18. Ныне принято такое обозначение изотопов: слева внизу от символа элемента дается величина Z, слева вверху - величина А. Например: 168O, 178O, 188O.
После открытия явления искусственной радиоактивности с помощью ядерных реакций было получено более 1600 искусственных радиоактивных изотопов для элементов с Z от 1 до 107. У подавляющего большинства искусственных радиоизотопов очень малые периоды полураспада, измеряемые секундами и долями секунд; лишь немногие имеют сравнительно большую продолжительность жизни (например, 10Ве - 2,7 · 106 лет, 26А1-8 · 105 лет и т.д.).
Стабильные элементы представлены в природе примерно 280 изотопами. Однако некоторые из них оказались в слабой степени радиоактивными, с огромными периодами полураспада (например, 40К, 87Rb, 138La, 147Sm, 176Lu, 187Re). Продолжительность жизни этих изотопов столь велика, что позволяет рассматривать их как стабильные.
В мире стабильных изотопов пока немало загадок. Так, неясно, почему их количество у разных элементов так сильно различается. Около 25% стабильных элементов (Be, F, Na, Al, Р, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tu, Та, Au) представлены в природе лишь одним видом атомов. Это так называемые элементы-одиночки. Интересно, что все они (кроме Be) имеют нечетные значения Z. И вообще для нечетных элементов число стабильных изотопов не превышает двух. Напротив, некоторые элементы с четными Z состоят из большого числа изотопов (например, Хе имеет 9, Sn-10 стабильных изотопов). Строгого научного объяснения этих фактов до сих пор не существует.
Совокупность стабильных изотопов у данного элемента называют плеядой. Содержание их в плеяде нередко сильно колеблется. Интересно отметить, что больше всего изотопов с величинами массовых чисел, кратных четырем (12С, 16О, 20Са и т. д.), хотя есть и исключения из этого правила.
Открытие стабильных изотопов позволило разгадать многолетнюю загадку атомных масс - их отклонение от целых чисел, объясняющееся различным процентным содержанием стабильных изотопов элементов в плеяде.
Если изотопы двух различных элементов имеют одинаковые массовые числа, то они называются изобарами ("барос" по-гречески - "тяжелый"). В 1934 г. немецкий ученый И. Маттаух сформулировал правило: если два изобара различаются по значениям Z на единицу, то один из них радиоактивен. Например, в паре изобаров 4018Ar-4019K - последний обнаруживает свойства радиоактивности. Правило Маттауха позволило объяснить отсутствие стабильных изотопов у Тс (Z = 43) и Pm (Z = 61); соседние с ними элементы Мо и Ru; Nd и Sm представлены в природе стабильными изотопами в широком интервале массовых чисел.
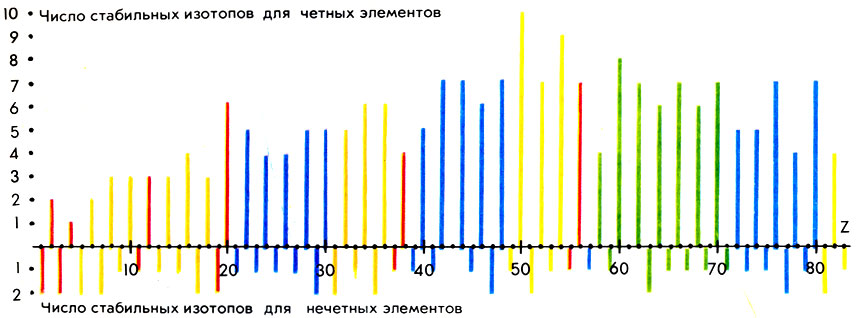
Числа стабильных изотопов для четных и нечетных элементов
Электронные оболочки у изотопов данного элемента построены совершенно одинаково. Поэтому практически тождественны их химические и физические свойства. Только изотопы водорода (протий и дейтерий) и их соединения обнаруживают заметные различия в свойствах. Например, тяжелая вода (D2O) кристаллизуется при +3,8, кипит при 101,4°С, имеет плотность 1,1059 г/см3, не поддерживает жизни животных и растительных организмов. При электролизе воды на водород и кислород разлагаются преимущественно молекулы Н2O, тогда как молекулы тяжелой воды остаются в электролизере.
Разделение изотопов других элементов - задача чрезвычайно сложная. Тем не менее во многих случаях необходимы изотопы отдельных элементов со значительно измененным по сравнению с природным содержанием. Например, при решении проблемы атомной энергии возникла необходимость разделения изотопов 235U и 238U. Для этой цели сначала был применен метод масс-спек-трометрии, с помощью которого в 1944 г. в США были получены первые килограммы урана-235. Однако этот метод оказался слишком дорогим и был заменен методом газовой диффузии, в котором использовался UF6. В наши дни используются несколько методов разделения изотопов, однако все они достаточно сложны и дороги. И все-таки проблема "разделения неразделимого" успешно решается.
Появилась новая научная дисциплина - химия изотопов. Она изучает поведение различных изотопов химических элементов в химических реакциях и процессы изотопного обмена. В результате этих процессов происходит перераспределение изотопов данного элемента между реагирующими веществами. Вот простейший пример: Н2O + HD = HDO + Н2 (молекула воды обменивает атом протия на атом дейтерия). Развивается и геохимия изотопов. Она исследует колебания изотопного состава разных элементов в земной коре.
Широчайшее применение находят так называемые меченые атомы - искусственные радиоактивные изотопы стабильных элементов или стабильные изотопы. С помощью изотопных индикаторов - меченых атомов - изучают пути перемещения элементов в неживой и живой природе, характер распределения веществ и элементов в различных объектах. Изотопы применяются в ядерной технике: как материалы конструкций ядерных реакторов; в качестве ядерного горючего (изотопы тория, урана, плутония); в термоядерном синтезе (дейтерий, 6Li, 3Не). Изотопы также широко используются в качестве источников излучений.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'