
Инертные газы
В 1962 г. на страницах химических журналов впервые появились формулы необычных химических соединений: XePtF6, XeF2,XeF4, XeF6. Появление этих веществ было неожиданно потому, что прежде никому в мире не удалось приготовить ни одного химического соединения инертных газов. Так называется совокупность химических элементов, располагающихся на правом фланге периодической системы: гелий, неон, аргон, криптон, ксенон, радон.
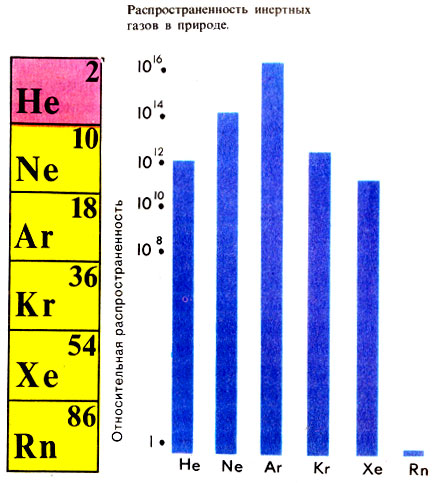
Распространенность инертных газов в природе
Способность инертных газов вступать в химические взаимодействия стала второй неожиданностью в их истории. Первая же состояла в самом факте их открытия, которое произошло в течение очень короткого времени - с 1894 по 1898 г. Состав земной атмосферы уже тогда считался хорошо изученным, и не было даже предположений о том, что она может содержать неизвестные газы элементарной природы.
Английский физик Дж. Рэлей обратил внимание на загадочное обстоятельство: плотности атмосферного азота и азота, полученного из химических соединений, различались. Пусть немного, но всегда на одну и ту же величину. Чтобы объяснить эту аномалию, Рэлей обратился за помощью к своему соотечественнику - химику и физику У. Рамзаю. Обсудив ситуацию и повторив эксперименты, ученые пришли к выводу, что в атмосферном азоте содержится примесь неизвестного газа. Его удалось выделить и определить спектр этого газа. Новый газ получил название аргон, что в переводе с древнегреческого означает "недеятельный", потому что аргон действительно оказался не способным вступать в химические реакции. Некоторое время его даже считали не химическим элементом, а аллотропным видоизменением (см. Аллотропия) азота (подобно тому, как известны кислород O2 и озон O3).
В 1895 г. из уранового минерала клевеита был выделен другой "бездеятельный элемент - гелий (еще раньше его нашли на Солнце и в вулканических газах, позднее его обнаружили и в земной атмосфере), а спустя 3 года из воздуха были выделены 3 инертных элемента - криптон, неон и ксенон (названия происходят от древнегреческих слов, означающих соответственно "скрытый", "новый", "чуждый"). Решающая роль в этих открытиях принадлежит У. Рамзаю. Выделить перечисленные газы помогла техника сжижения воздуха и разделения его на фракции, различающиеся по температурам сжижения. Наконец, в 1899 г. в Канаде Э. Резерфорд и Р. Оуэне, изучая явление радиоактивности, доказали существование последнего инертного газа - радона (название от элемента радия, продуктом радиоактивного распада которого и был радон).
Некоторое время ученые яростно спорили о том, как разместить инертные газы в периодической системе: ни в одной из ее 8 групп подходящего места не было. В конце концов в 1900 г. пришли к выводу, что целесообразно создать в периодической системе самостоятельную нулевую группу. С тех пор такая группа, включающая элементы с порядковыми номерами 2, 10, 18, 36, 54, 86, стала фигурировать в таблице Менделеева, инертные газы завершали ее периоды (с I по VI).
Объяснить химическую бездеятельность инертных газов удалось только после разработки планетарной модели атома. Атомы всех инертных газов, кроме гелия, имеют внешнюю электронную оболочку, содержащую 8 электронов. Такой электронный "октет" считался весьма устойчивым, и это представление легло в основу объяснения ионной и ковалентной химической связи (см. Химическая связь). Только в начале 60-х гг. XX в. оказалось, что неспособность инертных газов вступать в химические реакции - заблуждение ученых. Разрушить "броню неприступности" этих элементов помог неметалл - фтор.
Сегодня известно уже более 150 химических соединений ксенона, криптона и радона - фторидов, хлоридов, оксидов, кислот, солей и даже нитридов. Такое изобилие привело к тому, что в современной периодической системе нулевая группа упразднена: все инертные газы стали помещать в главную подгруппу VIII группы. Правда, с таким решением согласны не все химики: ведь для аргона получение химических соединений весьма проблематично, а для гелия и неона оно вообще едва ли возможно.
Но и само понятие "инертные", конечно, утратило свой прежний смысл. Нередко гелий и его аналоги называют также благородными газами (поскольку они, как ранее благородный металл золото, не "хотели" вступать в химические реакции). Когда-то У. Рамзай предлагал еще одно название: редкие. Он писал, что "ксенона в воздухе меньше, чем золота в морской воде", и был недалек от истины. Инертные газы действительно принадлежат к наименее распространенным на земле элементам (см. рисунок на с. 81). Наиболее "богата" земная атмосфера аргоном (его гораздо больше, чем всех остальных инертных газов, вместе взятых). Поэтому-то аргон и был открыт первым.
Инертные газы широко используются в науке и практике. Изучение свойств жидкого гелия привело к удивительным открытиям в физике (сверхтекучести, сверхпроводимости); газообразный гелий необходим для проведения многих научных исследований. Инертными газами заполняют светильники, трубки реклам, лампы различного назначения. Инертные газы используются в производстве сильно окисляющихся веществ. Химические соединения инертных газов также интересны не только для теоретиков; они - сильнейшие окислители и поэтому позволили осуществить некоторые казавшиеся ранее необычными химические реакции, например получение соединений пятивалентного золота.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'