
Источники тока химические
Это устройства, вырабатывающие электрический ток за счет энергии окислительно-восстановительных реакций химических реагентов. Простейший пример химического источника тока - элемент Даниэля-Якоби, разработанный в ч 1836-1840 гг. Он состоит из медного и цинкового электродов, погруженных в растворы соответственно сульфата меди и сульфата цинка, которые отделены друг от друга пористой перегородкой. Обозначается эта система следующим образом:
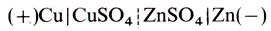
Как известно, в металлах имеются свободные носители электрического заряда - электроны. В растворе электролита эту функцию выполняют ионы. При погружении металлических электродов в электролит между ними возникает разность электродных потенциалов. Каждый металл имеет свое значение электродного потенциала. В качестве эталона принят так называемый водородный электрод (платина в растворе кислоты, насыщенной водородом), электродный потенциал которого при давлении водорода 1 ат считается равным нулю при всех температурах. Потенциал металла, погруженного в раствор соли, по отношению к этому электроду называется электродным потенциалом металла. В соответствии с величинами электродных потенциалов металлы располагают в ряд напряжений.
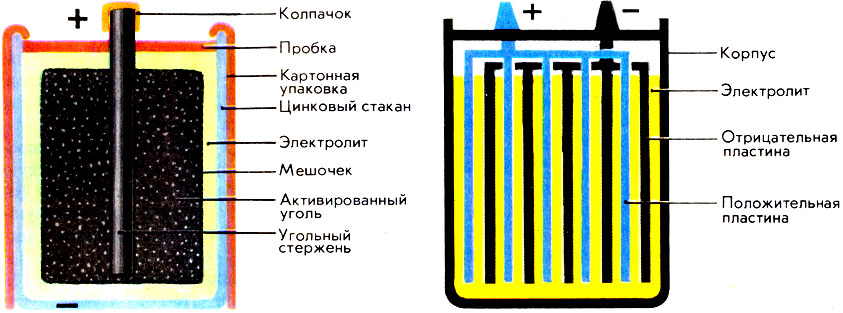
Самые распространенные химические источники тока - гальванический элемент одноразового пользования (слева) и аккумулятор (справа), который можно подзаряжать от электросети и использовать многократно
Поскольку химическая природа электродов (в данном случае Си и Zn) не одинакова, их электродные потенциалы различны, и между ними возникает электродвижущая сила-ЭДС. Если теперь соединить электроды внешней электрической цепью, в ней пойдет ток. При этом следует учесть, что электродный потенциал цинка менее положителен, чем меди. Поэтому цинковый электрод (анод), постепенно окисляясь, растворяется в электролите, а электроны, которые он отдает, восстанавливают на медном катоде ионы меди:
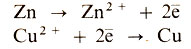
Суммарная реакция вытеснения меди цинком из раствора выглядит так:
Zn + CuSO4 → ZnSO4 + Сu
Химические источники тока делят на две большие группы - гальванические элементы и аккумуляторы. Гальванический элемент можно использовать лишь один раз; прошла реакция - и он становится негодным. Аккумулятор же можно зарядить снова; для этого через него пропускают ток в направлении, обратном рабочему.
Срок работы гальванического элемента можно значительно продлить, постоянно пополняя запас активных реагентов. Такие гальванические элементы называются электрохимическими генераторами.
В последнее время интенсивно используются топливные элементы, в которых химическая энергия реакции окисления топлива кислородом непосредственно преобразуется в электрическую.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'