
Квантовая химия
Квантовая химия - это отнюдь не "химия квантов", как на первый взгляд можно было бы расшифровать данное словосочетание. Скорее, "химией квантов" правомернее назвать фотохимию, изучающую протекание химических процессов под действием фотонов - квантов света.
Квантовая химия - это область теоретической химии. Эксперимент для нее важен лишь как путь проверки теоретических положений. Она опирается на фундаментальное представление физики о том, что электрон одновременно может рассматриваться и как частица, и как волна. "Язык" квантовой химии - это очень сложные математические уравнения, составляющие аппарат квантовой механики.
В чем состоит основная задача квантовой химии? Прежде всего - в теоретическом объяснении взаимодействия атомов в молекулах и в более сложных материальных образованиях. Например, квантовая химия объясняет, почему образуется химическое соединение Н2СО3, но невозможно существование соединения Н4СO4. Она доказывает также, почему различные галогены - сходные элементы одной и той же VII а подгруппы таблицы Менделеева - образуют друг с другом многочисленные и прочные соединения. И почему инертные газы - ксенон, криптон и радон - оказываются способными к химическим взаимодействиям, несмотря на то что внешняя электронная оболочка их атомов содержит, казалось бы, незыблемый "октет" электронов. Прежние, классические представления об ионной и ковалентной связях (см. Химическая связь) были бессильны в решении подобных проблем. Конечно же, эти представления не утратили своей наглядности и полезности до сих пор. Но они находятся в таком же отношении к квантовой химии, как обыкновенная арифметика к высшей математике. Образно говоря, квантовомеханические представления дали химику-теоретику столько же, сколько дало естествоиспытателю изобретение микроскопа.
Исходный пункт квантовой химии - уравнение, выведенное в 1926 г. австрийским физиком Э. Шредингером. Вот как оно выглядит:
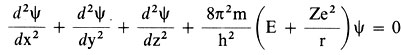
Математик называет его дифференциальным уравнением второго порядка в частных производных. Входящие в него величины читателю наверняка знакомы: m, е и r - это соответственно масса, заряд электрона и его расстояние от ядра; Е - сумма кинетической и потенциальной энергий электрона; х, у и z - ero координаты, a h - постоянная Планка. Что такое π - пояснять не надо. Только величина ψ, быть может, незнакома читателю, но она-то и является "альфой и омегой" квантовой механики. Именуемая волновой функцией, величина ψ характеризует степень вероятности нахождения электрона в определенной точке пространства вокруг атомного ядра (см. Атом). В конечном счете она дает возможность судить о специфических особенностях и энергии валентных электронов, т.е. электронов, участвующих в химических взаимодействиях.
Первым успехом квантовой химии было объяснение устойчивости молекулы водорода Н2. Эту задачу решили в 1927 г. немецкие теоретики Ф. Лондон и В. Гейтлер. Они первыми показали, что природу химической связи можно вскрыть только на основе методов квантовой механики. С тех пор представления и идеи квантовой химии непрерывно усложняются. Вместо одного уравнения приходится решать большую их совокупность - надежно и быстро это способны сделать только электронные вычислительные машины. Ныне в мире издается несколько журналов, специально посвященных проблемам квантовой химии. В химических вузах есть специальность "квантовая химия". Чтобы постичь ее, мало быть даже знающим химиком. Нужно также овладеть многими разделами физики и математики. Достижения квантовой химии во многом определяют развитие современной теоретической химии.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'