
Концентрация растворов
Концентрацией раствора называется количество (масса или объем) растворенного вещества, содержащееся в определенном количестве (массе или объеме) раствора или растворителя. Ее выражают различными способами. В химии наиболее часто применяются следующие способы:
1. Процентная концентрация по массе - это отношение массы растворенного вещества к массе всего раствора, умноженное на 100. Если раствор состоит из компонентов А и В, то процент компонента А вычисляется по формуле:
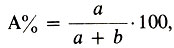
где а и b - массовые количества каждого компонента раствора. Например, 5%-ный раствор гидроксида натрия содержит 5 г гидроксида натрия в 100 г раствора, или, что то же самое, 5 г гидроксида натрия приходится на 100 - 5 = 95 г воды. Процентная концентрация - безразмерная величина.
2. Молярная концентрация, или молярность, выражается числом молей растворенного вещества, содержащихся в 1 л раствора. Раствор, в 1 л которого содержится один моль растворенного вещества, называется молярным. Если в 1 л раствора содержится 0,1 моль вещества, то он называется децимолярным, 0,01 моль-сантимолярным, 0,001 моль-миллимолярным. Размерность молярной концентрации-моль/л.
Молярность раствора обычно обозначается буквой М. Например, 1 М NaOH - молярный раствор гидроксида натрия, 1 л такого раствора содержит 40 г NaOH; 0,01 М NaOH - сантимолярный раствор, 1 л его содержит 0,01 моль, т.е. 0,4 г NaOH, и т.д. Чтобы приготовить, например, децимолярный раствор гидроксида натрия, надо взвесить 0,1 моль его, т. е. 4 г внести в литровую мерную колбу, на горлышке которой отмечен объем, точно равный 1 л, добавить воды до полного растворения вещества и затем раствор довести до метки (нижняя часть мениска должна касаться метки) и тщательно перемешать.
3. Моляльная концентрация, или м о-ляльность - это число молей растворенного вещества, содержащихся в 1 кг растворителя. Например, одномоляльный водный раствор серной кислоты состоит из 98 г кислоты и 1 кг воды. Если в 1 кг воды растворено 0,5/моля вещества, то такой раствор называется полумоляльным. Размерность моляльной концентрации - моль/кг. Моляльность обычно обозначается буквой m.
4. Нормальная концентрация, или нормальность, выражается числом эквивалентов вещества, содержащихся в 1 л раствора. Раствор, в 1 л которого содержится один эквивалент (экв) растворенного вещества, называется нормальным. Если в 1 л раствора содержится 0,1 экв вещества, то он называется децинормальным, 0,01 экв-сантинормальным, 0,001 экв-миллинормальным. Нормальность обычно обозначается буквой н. (иногда N).
Так, например, 1 н. H2SO4 - нормальный раствор серной кислоты, 1 л такого раствора содержит 1 экв, т.е. 49 г H2SO4; 0,01 н. NaOH-сантинормальный раствор гидроксида натрия, 1 л его содержит 0,01 экв, т.е. 40/100 = 0,4 г NaOH, и т.д.
Нормальный раствор готовится аналогично молярному.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'