
Литий
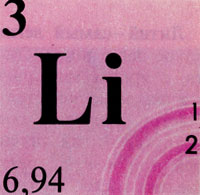
Литий (лат. Lithium) - химический элемент I группы периодической системы Менделеева, атомный номер 3, атомная масса 6,94; относится к щелочным металлам
Открыт литий в 1817 г. шведским химиком А. Арфведсоном при анализе минерала пета-лита LiAl [Si4O10]. Этот минерал выглядит как самый обыкновенный камень, и поэтому металл назвали литием, от греческого "литое" - "камень".
Лития в земной коре содержится 3,2 · 10-3% от общей массы. Известно около 30 минералов лития, 5 из них имеют промышленное значение.
Минерал, из которого получают литий, - алюмосиликат LiAl[Si2O6], или сподумен, - не совсем обычный. Две его разновидности - зеленый гидценит и светло-фиолетовый кунцитдрагоценные камни. Сподумен образует самые большие в мире кристаллы, до нескольких метров. В США, в Южной Дакоте, был найден кристалл сподумена длиной 14 м и весом около 90 т.

Литий - самый легкий, из металлов, почти вдвое легче воды. Он серебристо-белого цвета, с ярким металлическим блеском. Литий мягок, легко режется ножом. На воздухе он быстро тускнеет, соединяясь с кислородом воздуха. Литий значительно слабее, чем калий или натрий, реагирует с водой, образуя щелочь LiOH. При этом он не воспламеняется, как это происходит в реакции калия с водой. Зато с азотом, углеродом, водородом литий реагирует легче других щелочных металлов. Это один из немногих элементов, которые непосредственно соединяются с азотом.
Некоторые соли лития (карбонат, фторид и др.), в отличие от аналогичных солей его соседей по группе, плохо растворяются в воде.
Долгое время и литий, и его соединения почти не находили практического применения. Лишь в XX в. их стали использовать в производстве аккумуляторов, в химической промышленности как катализаторы, в металлургии. Сплавы лития легки, прочны, пластичны. Но главная область применения лития сегодня - атомная техника.
Один из двух природных изотопов лития - 6Li оказался самым доступным источником промышленного получения тяжелого изотопа водорода - трития, участвующего в термоядерной реакции. Другой изотоп лития - 7Li используют в качестве теплоносителя для ядерных реакторов. Так "безработный" в прошлом веке элемент в наши дни стал необходимым.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'