
Металлы
Химические элементы, образующие в свободном состоянии простые вещества с металлической связью. Из 107 известных химических элементов (см. Периодическая система химических элементов) 85-металлы и только 22-неметаллы.
Такие металлы, как золото, серебро и медь, известны человеку с доисторических времен. В древние и средние века считали, что существует только 7 металлов (золото, серебро, медь, олово, свинец, железо и ртуть). М. В. Ломоносов определял металл как "светлое тело, которое ковать можно" и относил к металлам золото, серебро, медь, олово, железо и свинец. Л. Лавуазье в "Начальном курсе химии" (1789) упоминал уже 17 металлов. В начале XIX в. последовало открытие платиновых металлов, затем щелочных, щелочноземельных и ряда других.
Триумфом периодического закона было открытие металлов, предсказанных на его основе Д. И. Менделеевым,- галлия, скандия и германия. В середине XX в. с помощью ядерных реакций были получены трансурановые элементы - не существующие в природе радиоактивные металлы.
Современная металлургия получает свыше 75 металлов и на их основе более 5000 сплавов.
В основе структуры металлов лежит кристаллическая решетка из положительных ионов, погруженная в плотный газ подвижных электронов. Эти электроны компенсируют силы электрического отталкивания между положительными ионами и тем самым связывают их в твердые тела.
Такой тип химической связи называют металлической связью. Она обусловила важнейшие физические свойства металлов: пластичность, электропроводность, теплопроводность, металлический блеск.
Пластичность - это способность металлов изменять форму при ударе, прокатываться в тонкие листы и вытягиваться в проволоку. При этом происходит смещение атомов и ионов кристаллической решетки, однако связи между ними не разрываются, так как соответственно перемещаются и электроны, образующие связь. Пластичность металлов уменьшается в ряду Au, Ag, Си, Sn, Pb, Zn, Fe. Золото, например, можно прокатывать в листы толщиной до 0,003 мм, которые используют для золочения.
Высокая электропроводность металлов объясняется присутствием свободных электронов, которые под влиянием даже небольшой разности потенциалов перемещаются от отрицательного полюса к положительному. С повышением температуры колебания ионов и атомов металлов усиливаются, что затрудняет движение электронов и тем самым приводит к уменьшению электропроводности. При низких же температурах колебательное движение ионов и атомов, наоборот, сильно уменьшается, и электропроводность возрастает. Вблизи абсолютного нуля электрическое сопротивление у металлов практически отсутствует. Лучший проводник электричества - серебро, за ним идут медь, золото, алюминий, железо. Также изменяется и теплопроводность металлов, которая вызвана как высокой подвижностью свободных электронов, так и колебательным движением ионов, благодаря чему происходит быстрое выравнивание температуры в массе металла. Металлический блеск тоже связан с наличием свободных электронов.
Из других физических свойств металлов наибольший практический интерес представляют плотность, температура плавления и твердость. Самый легкий из металлов - литий (плотность 0,53 г/см3), самый тяжелый - осмий (22,6 г/см3). Металлы с плотностью меньше 5 г/см3 называются легкими, остальные - тяжелыми. Температуры плавления металлов различаются очень сильно: цезий и галлий можно расплавить теплом ладоней, а температура плавления вольфрама + 3410°С. При обычных условиях единственный жидкий металл - ртуть. В парообразном состоянии все металлы одноатомны, их кристаллическая решетка разрушается.
Металлы различаются по твердости. Самый твердый из них - хром - режет стекло, а самые мягкие - калий, рубидий и цезий -легко режутся ножом. Прочность, температура плавления и твердость зависят от прочности металлической связи. Она особенно велика у тяжелых металлов.
В технике сплавы на основе железа, т.е. чугун, сталь, а также само железо называются черными металлами, все остальные металлы называются цветными. Существуют и другие классификации металлов (см. Периодическая система химических элементов).

Металлы - химические элементы, способные отдавать внешние (валентные) электроны. В древности и в средние века было известно 7 металлов: золото, серебро, медь, олово, свинец, железо, ртуть. Многие века алхимики тщетно искали способы превращения металлов в золото. Железо служило для изготовления оружия и орудий труда. Свое ведущее место железо сохраняет и в наши дни. Особенно широко оно используется в металлургии. Важную роль в современной технике играют алюминий, медь и другие металлы
Химические свойства металлов определяются слабой связью валентных электронов с ядром атома. Атомы сравнительно легко отдают их, превращаясь при этом в положительно заряженные ионы. Поэтому металлы являются хорошими восстановителями. В этом их главное и наиболее общее химическое свойство.
Очевидно, как восстановители металлы должны вступать в реакции с различными окислителями, среди которых могут быть простые вещества (неметаллы), кислоты, соли менее активных металлов и некоторые другие вещества. Соединения металлов с кислородом называются оксидами, с галогенами - галогенидами, с серой - сульфидами, с азотом - нитридами, с фосфором - фосфидами, с углеродом -карбидами, с кремнием - силицидами, с бором - боридами, с водородом - гидридами и т. д. Многие из этих соединений нашли важное применение в технике.
При взаимодействии металлов с кислотами окислителем является ион водорода Н+ , который принимает электрон от атома металла:
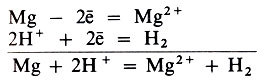
Все металлы, стоящие в ряду стандартных электродных потенциалов (ряду напряжений) левее водорода, вытесняют (восстанавливают) водород из разбавленных кислот типа НСl или H2SO4, а металлы, стоящие правее водорода, его не вытесняют.
Взаимодействие металлов с водными растворами солей менее активных металлов можно иллюстрировать примером:
Zn + CuSO4 = ZnSO4 + Сu
В этом случае происходит отрыв электронов от атомов более активного металла - цинка и присоединение их ионами менее активного Сu2+. Руководствуясь рядом стандартных электродных потенциалов, можно сказать, что каждый металл вытесняет (восстанавливает) из растворов их солей все следующие за ним металлы.
Активные металлы (щелочные и щелочноземельные) взаимодействуют и с водой, которая в этом случае выступает в роли окислителя.
Металлы, гидроксиды которых амфотерны (см. Амфотерность), как правило, взаимодействуют с растворами и кислот, и щелочей.
Металлы могут образовывать химические соединения между собой. Такие соединения обычно образуют типичные металлы с металлами, обладающими слабыми металлическими свойствами, например определенные соединения натрия со свинцом:
Na5Pb2, NaPb, Na2Pb, Na4Pb
Соединения одних металлов с другими носят общее название интерметаллидов, интерметаллических соединений, или металлидов.
Рассмотренные свойства металлов, связанные с отдачей электронов в химических реакциях, называют металлическими. В различной степени ими обладают все химические элементы. О металлических свойствах судят, сопоставляя электроотрицательности элементов. Эта величина, выраженная в условных единицах, характеризует способность атома в молекуле притягивать электроны. Относительные значения электроотрицательностей элементов приведены в таблице на с. 342. Чем меньше электроотрицательность, тем сильнее выражены металлические свойства элемента.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'