
Молекула
Молекулой называют наименьшую частицу вещества, обладающую его химическими свойствами.
Молекула состоит из атомов, а точнее, из атомных ядер, окруженных внутренними электронами, тогда как внешние, валентные электроны участвуют в образовании химических связей.
А, например, в случае инертных газов понятия атома и молекулы совпадают.
Каждая молекула имеет определенный качественный и количественный состав. Так, молекула воды состоит из атомов водорода и кислорода (качественный состав), причем в ней содержится один атом кислорода и два атома водорода (количественный состав). Иногда количественный состав молекул выражают в процентах (по массе): в Н2O-11,1% водорода и 88,9% кислорода.
Кроме состава молекулы характеризуются определенной структурой или строением. Часто термины "структура" и "строение" отождествляют, иногда же их различают, говоря о "ядерной структуре" и "электронном строении" молекул. Но в любом случае необходимо четко оговаривать, о чем идет речь: о взаимном расположении и перемещении атомных ядер или же о распределении электронной плотности.
Атомы в молекулах связаны в определенном порядке. Так, в молекуле аммиака NH3 каждый атом водорода соединен одной ковалентной связью с атомом азота; между самими водородными атомами химическая связь отсутствует (последнее, правда, не означает, что между химически несвязанными атомами отсутствует вообще всякое взаимодействие, (см. Химическая связь). Наличие связей между одними атомами и отсутствие их между другими наглядно изображают в виде так называемых графических, или структурных, формул (см. рис. на с. 171).
В последнее время в химической литературе все чаще употребляют термин "топология молекул". Топология - это раздел математики, изучающий свойства тел, не зависящие от их формы и размеров. Эти свойства называют неметрическими. Молекулы обладают как метрическими свойствами (длины химических связей, углы между ними и др.), так и неметрическими (молекула может быть циклической, скажем бензол, или нециклической н-бутан; иметь центральный атом, окруженный лигандами - РСl5, или представлять собой как бы "клетку" (см. рис. на с. 170, вверху) и т.д.). Под топологией молекулы понимают всю совокупность ее неметрических свойств. Топология молекулярных систем тесно связана с их свойствами. Например, молекулы этанола и диметилового эфира топологически различны (рис. на с. 170, в середине), что позволяет понять разницу в некоторых свойствах этих соединений (этанол может давать реакции с участием группы ОН и водорода этой группы, эфир - нет и т.д.). Но свойства молекул зависят не только от их топологии, но и от других факторов (геометрии молекулы, распределения электронной плотности в ней и др.) (см. Стереохимия).
В последние годы внимание ученых привлек новый класс молекулярных систем - так называемые нежесткие молекулы. Как известно, ядра в молекулах движутся. В силу резкого различия в массах ядер и электронов ядерные движения (колебания) происходят намного медленнее электронных, поэтому можно считать, что электроны в молекулах движутся в поле неподвижных атомных ядер. Конечно, такое допущение является приближением, которое называется адиабатическим. Для многих молекул, где ядра совершают небольшие по амплитуде колебания около определенных положений в пространстве, адиабатическое приближение вполне приемлемо. Такие молекулы называют структурно-жесткими, например СН4, Н2O и т.д. Однако есть молекулы, их называют нежесткими, в которых ядра совершают значительные перемещения. В подобных случаях понятие о неизменной равновесной геометрии молекулы теряет смысл. Например, в борогидриде лития LiBH4 катион Li+ как бы обращается вокруг аниона ВН-4 (см. рис. на с. 170, внизу). Разумеется, чтобы ион Li+ смог начать подобное "путешествие", молекула должна получить определенную энергию. Для нежестких молекул эта энергия невелика: для LiBH4 она составляет около 16 кДж/моль, т. е. во много раз меньше энергии химической связи. Другим примером нежесткой молекулы может служить аммиак NH3.
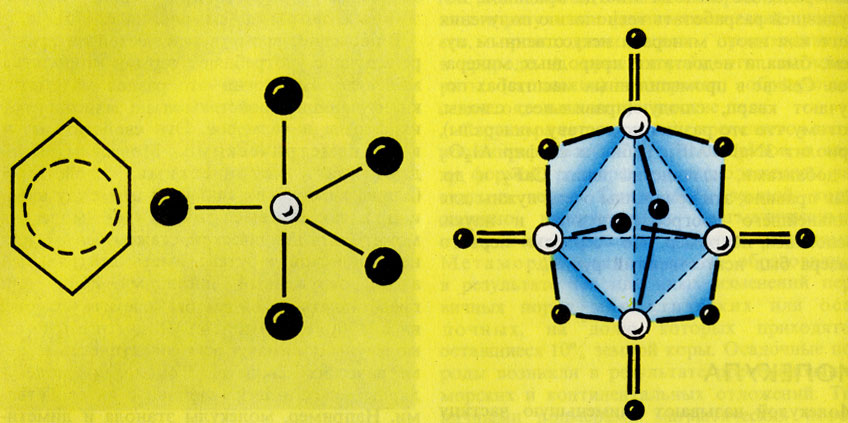
Различные топологические типы молекул (слева направо): молекула бензола C6H6 молекула пентахлорида фосфора РСl5; молекула - 'клетка' димерного оксида фосфора (V) Р4О10
Возвращаясь к "обычным", жестким, молекулам, следует отметить, что при одном и том же составе они могут иметь различную топологию и геометрию, т.е. давать разного типа изомеры (см. Изомерия; Таутомерия).
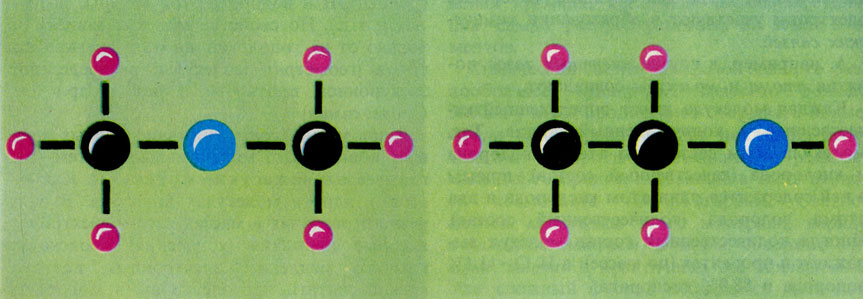
Графические формулы молекул диметилового эфира и этанола, иллюстрирующие различия в их топологии
Структура и даже состав молекул могут изменяться при изменении агрегатного состояния вещества и внешних условий, главным образом температуры и давления. Например, в газообразном оксиде азота (V) существуют отдельные молекулы N2O5, тогда как в твердом состоянии в узлах кристаллической решетки этого оксида находятся ионы NO2 и NO-3 т.е. можно сказать, что твердый N2O5 - это соль - нитрат нитрония.
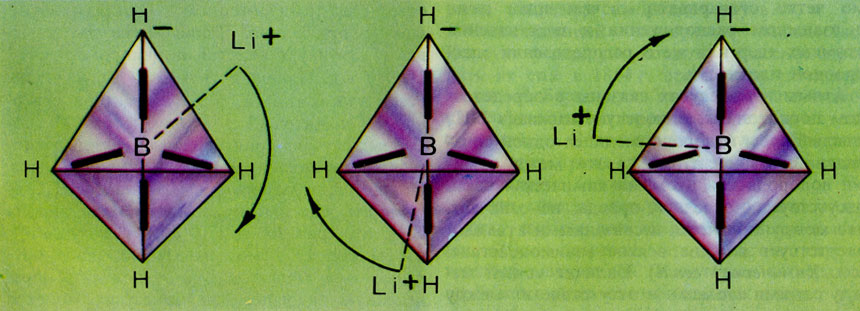
Вращение катиона Li+ вокруг тетраэдрического аниона ВН4
В твердом теле молекулы могут сохранять или не сохранять свою индивидуальность. Так, большинство органических соединений образуют молекулярные кристаллы, в узлах решеток которых находятся молекулы, связанные друг с другом относительно слабыми межмолекулярными взаимодействиями. В ионных (например, NaCl) и атомных (алмаз, графит) кристаллах нет отдельных молекул, и весь кристалл - это как бы одна гигантская молекула. Правда, в последнее время в теории твердого тела начали широко использовать молекулярные модели, однако это потребовало некоторого пересмотра понятия элементарной ячейки кристалла (см. К ристаллохимия).
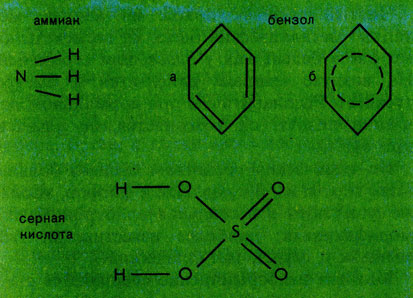
Графические формулы молекул аммиака, бензола, серной кислоты
Изучение строения и свойств молекул имеет фундаментальное значение для естествознания в целом.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'