
Н
Насыщенные углеводороды
Насыщенные углеводороды - класс углеводородов, в молекулах которых атомы углерода соединены друг с другом и атомами водорода простыми связями (см. Органическая химия). Все валентности атомов углерода в них насыщены до предела атомами водорода, поэтому их называют еще предельными углеводородами. Их называют также парафинами и чаще всего - алканами.
Простейший насыщенный углеводород - метан СН4. Метан и его гомологи - этан, пропан, бутан, а также изобутан при комнатной температуре являются газами (см. Гомология). Углеводороды с большей молекулярной массой - жидкости или твердые вещества.
Химические связи в молекулах насыщенных углеводородов обладают малой полярностью (см. Химическая связь). По этой причине соединения не взаимодействуют с полярными реагентами, но вступают в реакции, протекающие по радикальному механизму (см. Радикалы свободные). Так они хлорируются, бромируются, окисляются, нитруются азотной кислотой.
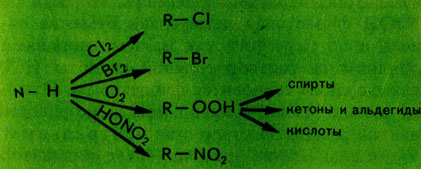
Насыщенные углеводороды поглощаются некоторыми простейшими организмами и под действием их ферментов превращаются в белки. Такой синтез белка очень эффективен и поэтому используется в микробиологической промышленности.
При нагревании в присутствии металлических и оксидных катализаторов насыщенные углеводороды образуют олефины, диены и даже ароматические соединения:
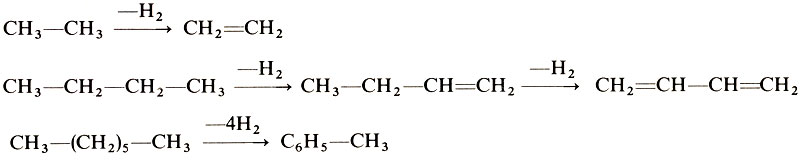
Высокотемпературное нагревание насыщенных углеводородов приводит к их распаду на насыщенные и ненасыщенные углеводороды с меньшей молекулярной массой, например:
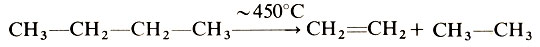
Этот процесс, называемый крекингом, нашел широкое использование в нефтехимии, в частности для получения важнейших мономеров - этилена, и пропилена.
Насыщенные углеводороды - важное сырье химической промышленности, а также топливо для двигателей внутреннего сгорания и других энергетических установок.
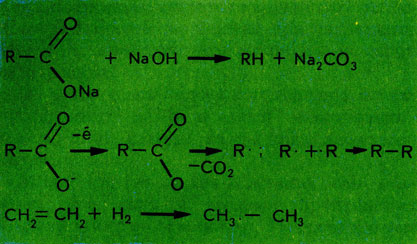
Основной источник насыщенных углеводородов - нефть и природный газ. В лаборатории их можно получить пиролизом солей карбоновых кислот в присутствии оснований, гидрированием (соединением с водородом) ненасыщенных углеводородов и другими способами:
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'