
Окислительно-восстановительные реакции
В давние времена, когда люди не знали химии, они не могли написать уравнение реакции растворения жемчужины в виноградном уксусе:
СаСO3 + 2СН3СООН = Са (СН3СОО)2 + Н2O + СO2
или даже более простой реакции сгорания алмаза на воздухе под действием солнечных лучей:
С + О2 = СО2
И уж тем более никто не смог бы разъяснить, что вторая реакция намного сложнее первой: ведь при ней происходит перемещение электронов от одного атома к другому, а значит, она относится к окислительно-восстановительным реакциям. В XVII в. считали, что окисление - это потеря флогистона (особого невидимого горючего вещества), а восстановление - его приобретение. Но после создания А. Лавуазье кислородной теории горения к началу XIX в. химики всего мира согласились считать окислением соединения веществ с кислородом, а восстановлением их превращения под действием водорода.

В химии окислительно-восстановительные реакции принадлежат к числу наиболее распространенных. Окисление и восстановление - взаимосвязанные процессы, которые всегда протекают одновременно. Когда одно вещество окисляется, то другое - восстанавливается, и наоборот. В живой природе энергия, выделяемая в процессе окислительно-восстановительных реакций, обеспечивает жизнедеятельность организмов. Дыхание, усвоение растениями углекислого газа с выделением кислорода (см. Фотосинтез), обмен веществ и другие биологически важные явления представляют собой окислительно-восстановительные реакции. Окислительно-восстановительные реакции лежат в основе процессов металлургии, технического производства важнейших химических продуктов (аммиака, азотной и серной кислот и др.), в основе процессов сжигания топлива и горения; они используются в химических источниках тока, обусловливая возникновение электродвижущей силы, и т.д

Понятие 'оксиды' включает бесконечное разнообразие веществ. Оксид водорода - это вода. Оксид кремния - это песок; кварц и его разновидности: халцедон (1), аметист (2), морион (3), рубин (4), сапфир (5), шпинель (6). Аметист - кристаллический оксид кремния, окрашенный в фиолетовый цвет оксидами марганца и кобальта (7). Оксиды могут быть газами, как, например, образующиеся в процессе горения (8) оксиды углерода. Оксиды широко используют на практике (9-15). Так, оксид фосфора (V) применяют для сушки химических реактивов, оксид хрома (ИТ) - для полирования линз и т. д. Некоторые оксиды входят в состав минеральных красок
Но вот простейшая реакция железа с соляной кислотой:
Fe + 2НСl = FeCl2 + Н2↑
Здесь нет кислорода, и тем не менее железо окисляется. В этой реакции окислитель - ион водорода - протон Н+ , а железо выступает в роли восстановителя.
Разобраться в этом удалось лишь с введением в химию электронных представлений. Теперь мы точно знаем, что окислитель - вещество, которое получает электроны, а восстановитель - вещество, которое их отдает. При электролизе электроны лишь переходят от одних молекул или атомов к другим (см. Электролитическая диссоциация). Тем более неизбежен такой переход при обычных окислительно-восстановительных реакциях. Эти две реакции всегда сопряжены, всегда происходят одновременно. Рассматривать, изучать, практически использовать окисление можно только в сочетании с восстановлением. Будет это доменный процесс - восстановление железа из оксидов коксом и оксидом углерода; биохимические процессы дыхания, брожения, фотосинтеза, электрометаллургия или изготовление красителей и лекарств - анализ всех этих процессов связан с учетом того, сколько электронов отдал или принял каждый участвующий в реакции атом, как изменилась его степень окисления. В связи с этим записываются коэффициенты уравнений реакций, например:
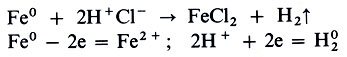
Для того чтобы предсказать, какой атом будет отдавать, а какой - принимать электроны, химики пользуются понятием электроотрицательности, т.е. способности атомов в молекуле притягивать и удерживать около себя электроны.
Восстановителями являются почти все металлы в свободном состоянии, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшем валентном состоянии, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления.
Окислителями могут быть нейтральные атомы и молекулы неметаллов, в особенности галогенов и кислорода, положительно заряженные ионы металлов в высшей степени окисления, сложные ионы и молекулы, содержащие атомы элементов в более высокой степени окисления. Самый сильный окислитель - электрический ток (поток отрицательно заряженных электронов). При этом окисление происходит на аноде.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'