
Р
Равновесие химическое
Можно ли держать в одной колбе вместе основание и кислоту! Ответ на этот вопрос не так прост, как может показаться сразу: нельзя, потому что в результате начавшейся реакции сразу же образуются соль и вода. Но бывают случаи, когда свободное основание и свободная кислота могут мирно сосуществовать в одной колбе. Возьмем соль, например хлорид алюминия, - и попытаемся растворить ее в воде. Конечно, произойдет гидролиз по уравнению:
2АlСl3 + 6Н2O = 2Аl(ОН)3 + 6НСl (1)
Но эта реакция обратимая:
6НСl + 2Аl(ОН)3 = 2АlСl3 + 6Н2O (2)
Сколько бы мы ни выдерживали смесь, как бы ее ни перемешивали - она остается мутноватой, будет содержать студенистый осадок амфотерного гидроксида алюминия, в данной системе выступающего как основание (см. Амфотерность). А значит, там же всегда будет находиться и какое-то количество соляной кислоты. Основание и кислота в одной колбе. Почему они могут сосуществовать? Потому что в той же колбе есть еще избыток воды и хлорид алюминия, способные реагировать друг с другом. Одновременно идут с одинаковой скоростью реакции (1) и (2). При этом в единицу времени образуется столько же новых веществ, сколько расходуется начальных соединений. Такое состояние системы называется химическим равновесием.
Смешаем в газовой фазе или в разбавленном растворе два вещества А и В, которые могут реагировать друг с другом с образованием продуктов реакции С и D. Допустим, что это обратимая реакция; большинство химических реакций обратимые, т.е. при взаимодействии веществ С и D вновь образуются А и В:
А + В ↔ С + D
В самом начале реакции, когда веществ А и В много, а С и D еще мало, скорость прямой реакции V1 велика:
V1 = К1 · [А] · [В],
где К1 - константа скорости прямой реакции, а [А] и [В] - концентрации исходных реагентов.
Через некоторое время часть молекул А и В прореагирует и концентрация их упадет; скорость прямой реакции уменьшится. В то же время возрастут концентрация продуктов реакции (С и D) и скорость взаимодействия между ними V2. Она определяется по аналогичной формуле: V2 = K2 · [C] · [D],
В какой-то момент скорости прямой и обратной реакций сравняются, установится динамическое равновесие, постоянное для данной системы при данных условиях. Вывести систему из равновесия можно, только меняя условия, по принципу Ле Шателье. Какими бы ни были исходные концентрации, равновесные концентрации реагентов и продуктов реакции строго связаны между собой законом действия масс, и их можно рассчитать, определив значение константы равновесия Кр.
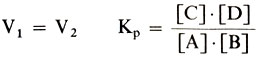
Определив константу равновесия в лабораторных опытах, нетрудно рассчитать состав равновесной смеси. Но и это еще не все. Воздействуя на равновесную смесь тем или иным способом, например добавляя в нее один из исходных реагентов в избытке (на практике для этого чаще всего берут самый дешевый из них), можно смещать равновесие и получать больше самых нужных, или, как говорят химики, целевых, продуктов. Например, в реакции гидролиза хлорида алюминия:
2АlСl3 + 6Н2O = 2Аl(ОН)3 + 6НСl
взвесь Аl(ОН)3 можно удалить, предусмотрев в установке устройство для фильтрования жидкости. Удалив гидроксид алюминия из системы, мы тем самым ускорим гидролиз АlСl3. На практике иногда удается смещать равновесие реакций, связывая один из продуктов реакции в комплексное соединение. Так поступают, в частности, при умягчении воды с помощью комплексообразующих соединений.
Понятие о химическом равновесии объясняет и эмпирическое правило, гласящее, что реакция идет до конца, если один из ее продуктов выпадает в осадок или улетучивается в виде газа. Теперь мы знаем, что с осадком и газом часть вещества оказалась выведенной из реакции. Это повлияло на соотношение (концентрации) реагентов и сместило химическое равновесие. Все произошло в соответствии с положениями закона действия масс.
В отдельных случаях, когда проведение экспериментальных исследований затруднительно, константы равновесия химических реакций рассчитывают с помощью методов химической термодинамики. При этом иногда удается определить не только состав реакционной смеси и выход продуктов реакции, но и способы увеличения выхода целевого продукта: давление, нагрев (подвод энергии извне) или, наоборот, быстрое охлаждение...
Катализаторы не влияют на положение равновесия. В равной мере ускоряя и прямую и обратную реакции, они помогают скорее достичь равновесия, но не сдвинуть его в какую-либо сторону.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'