
Соли
Соли - класс химических соединений, кристаллические вещества, имеющие ионную структуру (см. Ионы). В XVI в. алхимики (см. Алхимия) употребляли понятие "соли" для характеристики растворимости металлов, однако по мере развития химии оно стало все больше связываться с реакциями кислот и оснований. Так, в начале XIX в. шведский химик Й. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями, или соединений, полученных заменой атома водорода в кислоте металлом. В теории электролитической диссоциации солями называют соединения, диссоциирующие в растворе на катионы металлов или группы атомов, которые ведут себя подобно катионам металлов (положительно заряженные ионы), и анионы (отрицательно заряженные ионы) - кислотные остатки:
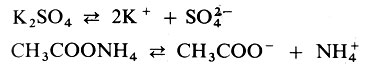
При определении типов солей исходят главным образом из содержания в них остатков кислот и оснований и состава катионов. Так, если при образовании соли из сильной кислоты и сильного основания все ионы Н+ нейтрализованы ионами ОН-, то из раствора получают среднюю соль:
H2SO4 + 2КОН = K2SO4 + 2Н2O
Если нейтрализованы не все ионы Н+, образуется кислая соль:
H2SO4 + КОН = KHSO4 + Н2О
НООС - СООН + КОН = КООССООН + Н2О
Основные соли, кроме ионов металлов и кислотных остатков, содержат гидроксильную группу ОН-:
НСl + Mg(OH)2 = Mg(OH)Cl + Н2О
В состав двойных солей входят катионы разных металлов, например KAl(SO4)2, а в состав смешанных солей - анионы различных кислот, например CaCl(OCl). Поскольку углеводородный радикал (остаток, который получается, если отнять от молекулы углеводорода один или несколько атомов водорода) может содержать как основные, так и кислотные группы (см. Карбо-новые кислоты), то такие вещества, например аминокислоты, могут образовывать внутренние соли:
H2NCH2COOH ↔ H3N+ СН2СОО-
Соли органических кислот обычно выделяют в отдельную группу, так как их физические и химические свойства во многом определяются структурой углеводородного радикала.
Многие соли хорошо растворяются в полярных растворителях (см. Химическая связь). За исключением солей сильных кислот и оснований, все соли подвергаются гидролизу при растворении в воде, т. е. их ионы реагируют с водой.
К солям с обычными (не сложными) катионами: Na+, К+, NH+4, Mg2+, Са2+, Sr2+, Ва2+, Al3+, Hg2+, Cr3+, Mn2+, Fe2+, Fe3+, Со2+, Ni2+, Cu2+, Zn2+, Ag+, Cd2+, Sn2+ и Pb2+ применимы простые правила растворимости в воде: все нитраты и ацетаты-соли азотной и уксусной кислот-растворимы; все хлориды, бромиды и иодиды - соли соляной, бромо- и иодоводородной кислот - растворимы, за исключением соответствующих соединений серебра, одновалентной ртути и свинца; все сульфаты - соли серной кислоты - растворимы, кроме сульфатов бария, стронция и свинца; все соли натрия, калия и аммония растворимы, исключение составляют комплексные соли NaSb(OH)6, K3Co(NO2)6, K2PtCl6, (NH4)2PtCl6 и (NH4)3Co(NO2)6; все средние карбонаты и фосфаты-соли угольной и фосфорной кислот - не растворимы, кроме соответствующих соединений щелочных металлов и аммония (сложные однозарядные ионы NH+4); все сульфиды - соединения серы с металлами, за исключением сульфидов щелочных и щелочноземельных металлов и аммония, не растворимы. Растворимость солей в воде играет решающую роль в распределении многих элементов в природе.
Комплексные соли образуются при реакции солей друг с другом:
AgCl + 2NaCN = NaAg(CN)2 + NaCl
Для многих из них характерно сложное строение аниона, который содержит атом переходного металла, например: K4[Fe(CN)6]. Часто растворимость комплексных солей выше растворимости исходных простых солей. Это свойство используется для выделения ценных металлов. Так, вышеприведенная реакция применяется при выделении серебра из минерала кераргирита AgCl. Яркую окраску комплексных солей используют для обнаружения катионов многих металлов в сложных минеральных и органических веществах (см. Колориметрия).
Согласно ряду напряжений металлы в солях вытесняют друг друга:
CuSO4 + Zn = ZnSO4 + Сu,
а более сильные кислоты вытесняют более слабые и из их солей:
Na2CO3 + 2НСl = Н2СO3 + 2NaCl
Полярность ионных связей в солях различна и зависит от строения катиона и аниона (см. Химическая связь). Соли с сильно полярными связями плавятся при более высоких температурах, чем соли с менее полярными связями (так, температура плавления КС1 + 776°, a CuCl + 442°С).
Изменение концентрации растворов солей при испарении водоемов приводит к образованию пластов кристаллов солей (например, каменная соль), а обменные реакции их катионов и анионов вызывают образование нерастворимых осадков - известняка (СаСО3), гипса (CaSO4 · 2H2O) или сульфидов металлов. Человек издавна использовал залежи минеральных солей или выделял соли из растворов.
Применение солей чрезвычайно разнообразно: в красильном деле (соли хрома), как строительный материал, исходное сырье для получения различных металлов (руды меди, цинка и свинца - халькоцит, сфалерит и галенит - представляют собой сульфиды этих металлов). Электролизом (см. Электролитическая диссоциация) соответствующих солей получают галогены и ряд металлов. Широко используют соли и в качестве удобрений (селитры NaNO3 и NH4NO3, различные фосфаты). Нитрит калия KNO2 применяется для консервирования мяса, а натриевая соль салициловой кислоты
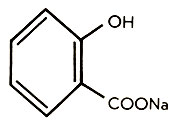
как известное лекарство. Всякий живой организм, в том числе и организм человека, в котором соли составляют 5,5% массы тела, остро нуждается в постоянном поддержании солевого равновесия.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'