
Спектральный анализ
Спектральный анализ - один из самых важных физических методов исследования веществ. Предназначен для определения качественного и количественного состава вещества на основе его спектра.
Химикам издавна было известно, что соединения некоторых химических элементов, если их внести в пламя, окрашивают его в характерные цвета. Так, соли натрия делают пламя желтым, а соединения бора - зеленым. Окраска вещества возникает, когда оно либо излучает волны определенной длины, либо поглощает их из полного спектра падающего на него белого света. Во втором случае цвет, видимый глазом, оказывается соответствующим не этим поглощенным волнам, а другим - дополнительным, дающим при сложении с ними белый свет.
Эти закономерности, установленные еще в начале прошлого века, были обобщены в 1859-1861 гг. немецкими учеными Г. Кирхгофом и Р. Бунзеном, доказавшими, что каждый химический элемент имеет свой ха-рактерный спектр. Это позволило впоследствии создать разновидность элементного анализа-атомный спектральный анализ, с помощью которого можно количественно определять содержание различных элементов в навеске вещества, разлагаемого на атомы или ионы в пламени или в электрической дуге. Еще до создания количественного варианта этого метода он успешно применялся для "элементного анализа" небесных тел. Спектральный анализ уже в прошлом веке помог исследовать состав Солнца и других звезд, а также открыть некоторые элементы, в частности гелий.
При помощи спектрального анализа стало возможным отличать не только различные химические элементы, но и изотопы одного и того же элемента, обычно дающие неодинаковые спектры. Метод применяется для анализа изотопного состава веществ.
Рентгеновские лучи, названные по имени открывшего их в 1895 г. немецкого физика В. Рентгена, - это одна из самых коротковолновых частей полного спектра электромагнитных волн, расположенная в нем между ультрафиолетовым светом и гамма-излучением. При поглощении рентгеновских лучей атомами возбуждаются глубинные электроны, расположенные вблизи ядра и связанные с ним особенно прочно. Испускание атомами рентгеновских лучей, наоборот, связано с переходами глубинных электронов с возбужденных энергетических уровней на обычные, стационарные.
И те и другие уровни могут обладать только строго определенными энергиями, зависящими от заряда атомного ядра. Значит, разность этих энергий, равная энергии поглощаемого (или излучаемого) кванта, тоже зависит от заряда ядра, и излучение каждого химического элемента в рентгеновской области спектра представляет собой характерный для данного элемента набор волн со строго определенными частотами колебаний.

Спектр света, излучаемого атомами натрия
На использовании этого явления и основан рентген оспектральный анализ - разновидность элементного анализа. Он широко применяется для анализа руд, минералов, а также сложных неорганических и элемен-тоорганических соединений.
Существуют и другие виды спектроскопии, основанные не на излучении, а на поглощении веществом световых волн. Так называемые молекулярные спектры наблюдаются, как правило, при поглощении растворами веществ видимого, ультрафиолетового или инфракрасного света; разложения молекул при этом не происходит. Если видимый или ультрафиолетовый свет обычно действует на электроны, заставляя их подниматься на новые, возбужденные энергетические уровни (см. Атом), то инфракрасные (тепловые) лучи, несущие меньше энергии, возбуждают лишь колебания связанных между собой атомов. Поэтому информация, которую такие виды спектроскопии дают химикам, различна. Если из инфракрасного (колебательного) спектра узнают о наличии в веществе определенных групп атомов, то спектры в ультрафиолетовой (а для окрашенных веществ - и в видимой) области несут информацию о строении поглощающей свет группировки в целом.
Среди органических соединений основу таких группировок, как правило, составляет система ненасыщенных связей (см. Ненасыщенные углеводороды). Чем больше в молекуле двойных или тройных связей, чередующихся с простыми (иными словами, чем длиннее цепь сопряжения), тем легче возбуждаются электроны.
Методы молекулярной спектроскопии используют не только для определения строения молекул, но и для точного измерения количества известного вещества в растворе. Особенно удобны для этого спектры в ультрафиолетовой или видимой области.
Полосы поглощения в этой области обычно наблюдаются при концентрации растворенного вещества порядка сотых и даже тысячных долей процента. Частным случаем такого применения спектроскопии является метод колориметрии, широко применяемый для измерения концентрации окрашенных соединений.
Атомы некоторых веществ способны поглощать также и радиоволны. Такая способность проявляется при помещении вещества в поле мощного постоянного магнита. Многие атомные ядра обладают собственным магнитным моментом - спином, и в магнитном поле ядра с неодинаковой ориентацией спина оказываются энергетически "неравноправными". Те, у которых направление спина совпадает с направлением наложенного магнитного поля, попадают в более выгодное положение, а другие ориентации начинают играть по отношению к ним роль "возбужденных состояний". Это не значит, что ядро, находящееся в выгодном спиновом состоянии, не может перейти в "возбужденное"; разница энергий спиновых состояний очень невелика, но все же процент ядер, находящихся в невыгодном энергетическом состоянии, сравнительно мал. И он тем меньше, чем мощнее наложенное поле. Ядра как бы колеблются между двумя энергетическими состояниями. А поскольку частота таких колебаний соответствует частоте радиоволн, то возможен и резонанс - поглощение энергии переменного электромагнитного поля с соответствующей частотой, приводящее к резкому увеличению числа ядер, находящихся в возбужденном состоянии.
На этом и основана работа спектрометров ядерного магнитного резонанса (ЯMP), способных обнаруживать наличие в веществе тех атомных ядер, спин которых равен ½: водорода 1Н, лития 7Li, фтора 19F, фосфора 31Р, а также изотопов углерода 13С, азота 15N, кислорода 17O и т.д.
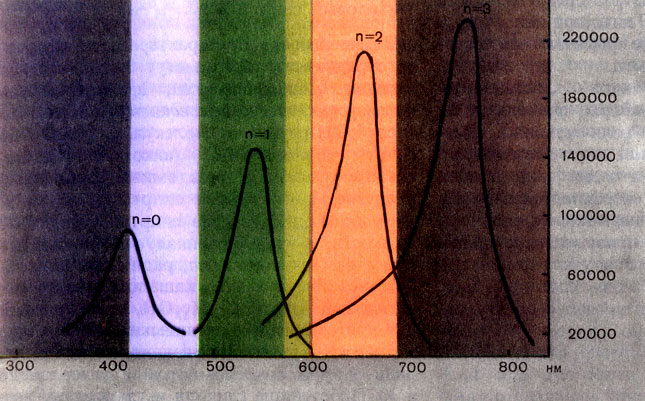
Спектры поглощения света растворами сложных органических красителей, формулы которых отличаются лишь длиной цепочки сопряженных связей n. Легко заметить, как резко сдвигается по мере удлинения цепочки полоса поглощения в область более длинных волн. Одновременно растет и высота волны. Первый краситель (n = 0 ) окрашен в голубой, а последний (n = 3) - в коричневый цвет
Чувствительность таких приборов тем выше, чем мощнее постоянный магнит. Пропорционально напряженности магнитного поля растет и резонансная частота, нужная для возбуждения ядер. Она служит мерой класса прибора. Спектрометры среднего класса работают на частоте 60 мгц (при записи протонных спектров); более классные - на частоте 90, 180 и даже 360 мгц.
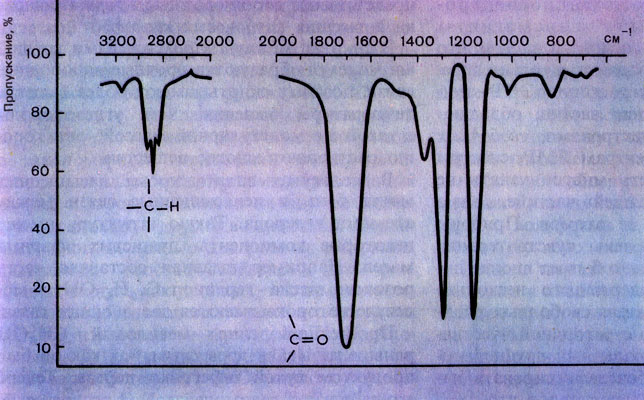
Инфракрасный (колебательный) спектр известного растворителя ацетона. Спектр подтверждает наличие в молекуле ацетона карбонильной группы >С = 0 (сильная полоса с волновым числом 1705 см-1) и связей С-Н (полосы около 2900 см-1)
Спектрометры высокого класса - очень точные и сложные приборы - позволяют не только обнаружить и количественно измерить содержание того или иного элемента, но и различить сигналы атомов, занимающих в молекуле химически "неравноправные" положения. А изучив так называемые спин-спиновое взаимодействие, приводящее к расщеплению сигналов на группы узких линий под влиянием магнитного поля соседних ядер, можно узнать много интересного об атомах, окружающих исследуемое ядро. ЯМР-спектроскопия позволяет получить от 70 до 100% информации, нужной, например, для того, чтобы установить строение сложного органического соединения.
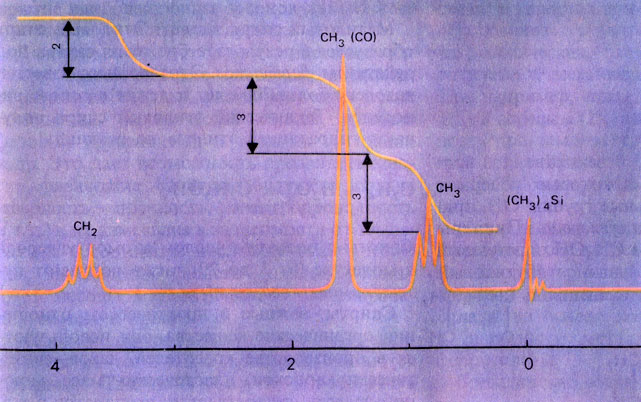
Спектр ЯМР на ядрах водорода этилового эфира уксусной кислоты - этилацетата, СН3СООСН2СН3. Первый пик справа - сигнал эталонного вещества тетраметилсилана (CH3)4Si, от которого принято отсчитывать положение остальных сигналов, так называемые химические сдвиги. Спектр доказывает наличие в молекуле вещества трех разных групп атомов водорода, количества которых относятся, как 3:3:2. Это показывает ступенчатая кривая, изображенная сверху. Две из этих групп - СН3 и СН2 - связаны между собой, так как их сигналы расщеплены соответственно на 3 и на 4 линии. А правило расщепления таково, что число линий всегда на единицу больше числа ядер водорода в соседней группе
Еше одна разновидность радиоспектроскопии - электронный парамагнитный резонанс (ЭПР) - основана на том, что спином, равным ½, обладают не только ядра, но и электроны. Спектроскопия ЭПР - лучший способ исследования частиц, обладающих неспаренными электронами, - свободных радикалов. Подобно спектрам ЯМР, спектры ЭПР дают возможность многое узнать не только о самой "сигналящей" частице, но и о природе окружающих ее атомов. Приборы спектроскопии ЭПР очень чувствительны: для записи спектра обычно бывает вполне достаточно раствора, содержащего несколько стомиллионных долей моля свободных радикалов на 1 л. А прибор с рекордной чувствительностью, недавно созданный группой советских ученых, способен зафиксировать наличие в образце всего 100 радикалов, что соответствует их концентрации примерно 10-18 моль/л.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'