
Степень окисления
Это одно из основных понятий химии, как и валентность. Оно введено для характеристики состояния атома в химических соединениях. При определении этого понятия условно полагают, что связующие (валентные) электроны переходят к более электроотрицательным атомам (см. Электроотрицательность), а потому соединения состоят как бы из положительно и отрицательно заряженных ионов. Степень окисления - условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов. Степень окисления может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху:
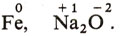
Нулевое значение степени окисления приписывается атомам элементов, находящихся в свободном состоянии, например: Сu, Н2, N2, Р4, S8. Отрицательное значение степени окисления имеют те атомы, в сторону которых смещается связующее электронное облако (электронная пара). У фтора во всех его соединениях она равна - 1. Положительную степень окисления имеют атомы, отдающие валентные электроны другим атомам. Например, у щелочных и щелочноземельных металлов она соответственно равна +1 и +2. В простых ионах, подобных Cl-, S2-, К+, Сu2+, Аl3+, она равна заряду иона. В большинстве соединений степень окисления атомов водорода равна +1, но в гидридах металлов (соединениях их с водородом) - NaH, СаН2 и других - она равна -1. Для кислорода характерна степень окисления -2, но, к примеру, в соединении с фтором OF2 она будет +2, а в перекисных соединениях (ВаO2 и др.) -1. В некоторых случаях эта величина может быть выражена и дробным числом: для железа в оксиде железа (II, III) Fe3O4 она равна + 8/3.
Алгебраическая сумма степеней окисления атомов в соединении равна нулю, а в сложном ионе - заряду иона. С помощью этого правила вычислим, например, степень окисления фосфора в ортофосфорной кислоте Н3РO4. Обозначив ее через х и умножив степень окисления для водорода (+1) и кислорода (-2) на число их атомов в соединении, получим уравнение:
(+1) · 3 + х + (-2) · 4 = 0, откуда х = +5.
Аналогично вычисляем степень окисления хрома х в ионе Сr2O2-7:
2х + (-2) · 7 = - 2; x = +6.
В соединениях МnО, Мn2О3, МnO2, Мn3O4, К2МnO4, КМnO4 степень окисления марганца будет соответственно +2, 4-3, +4, + 8/3, +6, +7.
Высшая степень окисления - это наибольшее положительное ее значение. Для большинства элементов она равна номеру группы в периодической системе и является важной количественной характеристикой элемента в его соединениях. Наименьшее значение степени окисления элемента, которое встречается в его соединениях, принято называть низшей степенью окисления; все остальные - промежуточными. Так, для серы высшая степень окисления равна +6, низшая -2, промежуточная +4.
Изменение степеней окисления элементов по группам периодической системы отражает периодичность изменения их химических свойств с ростом порядкового номера.
Понятие степени окисления элементов используется при классификации веществ, описании их свойств, составлении формул соединений и их международных названий. Но особенно широко оно применяется при изучении окислительно-восстановительных реакций. Понятие "степень окисления" часто используют в неорганической химии вместо понятия "валентность" (см. Валентность.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'