
Химическая связь
Природа химического взаимодействия на протяжении столетий была предметом размышлений многих поколений ученых и философов. В попытках разгадать тайну химического сродства веществ ученые сделали немало важных наблюдений, выдвинули множество интересных гипотез, но значительного успеха удалось добиться лишь с созданием в 1925-1927 гг. квантовой механики (см. Квантовая химия).
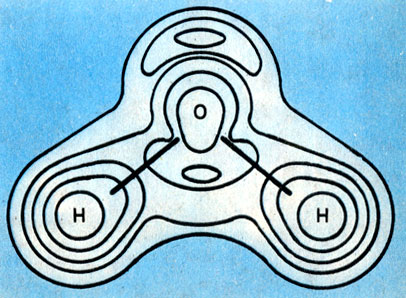
Рис. 1. Определенному расположению атомных ядер в пространстве отвечает некоторое распределение электронной плотности (вверху)
Согласно квантовомеханической теории, определенному расположению атомных ядер (см. Атом. Электрон) в пространстве отвечает некоторое распределение электронной плотности (см. рис. 1). При образовании молекулы электронные облака, соответствующие внешним, валентным, орбиталям атомов, перекрываются и между ядрами образуется некоторый отрицательный заряд, называемый зарядом перекрывания (рис. 2). Наличие значительной электронной плотности в межъядерном пространстве как бы "цементирует" молекулу, стягивая ядра к области перекрывания электронных облаков взаимодействующих атомов.
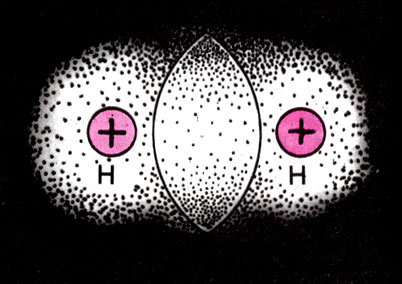
Рис. 2. Возникновение заряда перекрывания при образовании молекулы
То, что принято называть химической связью, представляет собой взаимодействие атомов, энергия которого лежит в пределах от нескольких десятков до примерно 1000 кДж/моль. Так, в молекуле Cs2 энергия связи составляет около 42 кДж/моль, тогда как в N2 она порядка 940 кДж/моль. Однако энергетический критерий еще не дает возможности отличить химическую связь от других видов взаимодействий (например, от межмолекулярного, энергия которого может достигать 80 кДж/моль). Правильнее будет определить химическую связь исходя из электронного строения соединений, ибо при всем разнообразии типов химического взаимодействия его характерная черта состоит в перестройке электронных оболочек связывающихся атомов. В результате этой перестройки происходит коллективизация (обобществление) валентных электронов атомов (см. Валентность) и перенос заряда (если связь образуется между различными атомами). Причем обобществление валентных электронов особенно важно, так как образование химической связи только путем переноса заряда от одного атома к другому без коллективизации электронов в природе не осуществляется. Иными словами, чисто ионные связи не существуют, хотя ионная модель химического взаимодействия во многих случаях (например, для описания сильно полярных соединений, находящихся в твердом состоянии, NaCl, КВr и т.д.) оказывается весьма полезной и правильно отражает основные свойства веществ.
Итак, под химической связью следует подразумевать ковалентную связь, т.е. межатомное взаимодействие, сопровождающееся перестройкой валентных электронных оболочек атомов и коллективизацией электронов. Это определение позволяет охватить практически все случаи химической связи.
Как правило, ковалентная связь осуществляется локализованной (сосредоточенной) между двумя атомами парой электронов с противоположно направленными (антипараллельными) спинами (спин - собственный момент количества движения элементарных частиц), т.е. представляет собой двухэлектронную двухцентровую связь (под "центром" понимают атомное ядро), сокращенно (2е- -2ц) - связь. Рассмотрим теперь более детально ковалентную связь в молекуле водорода (рис. 3). При ее образовании электронные 1s-облака (1s-орбитали) перекрываются и в пространстве между ядрами появляется некоторая дополнительная электронная плотность - отрицательный заряд перекрывания, стягивающий положительно заряженные ядра. Сближение ядер может происходить до тех пор, пока силы межъядерного отталкивания не будут уравновешены силами притяжения ядер к заряду перекрывания. Межъядерное расстояние, отвечающее равенству указанных сил, называется равновесным (Rравн) и принимается за длину химической связи. Энергия системы взаимодействия атомов по мере их сближения сначала падает, достигая минимума при R = Rравн, а затем возрастает, что свидетельствует о преобладании сил отталкивания между ядрами при сближении их на расстояние меньше Rравн.
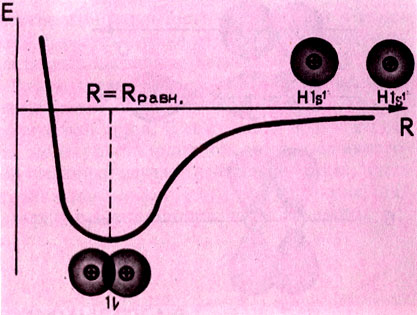
Рис. 3. Изменение энергии атомов водорода при образовании ими молекулы
Мы видим, что каждый валентный штрих в классической структурной химической фор-муле, как правило (но не всегда!), можно сопоставить с (2е- -2ц)-связью. Поэтому число химических связей, образуемых данным атомом, зависит в первую очередь от количества имеющихся в нем неспаренных электронов. Однако зачастую атом в молекуле дает связей больше, чем у него имеется неспаренных электронов в основном (невозбужденном) состоянии. Как же образуются эти "дополнительные" связи? В качестве примера обратимся к соединениям углерода. В подавляющем большинстве случаев атом С образует четыре ковалентные связи, хотя в основном состоянии у него только два неспаренных электрона. Но если, затратив некоторую энергию, возбудить атом так, чтобы один из 25-электронов перешел на свободную 2р-орбиталь, то число неспаренных электронов станет равным четырем (рис. 4).
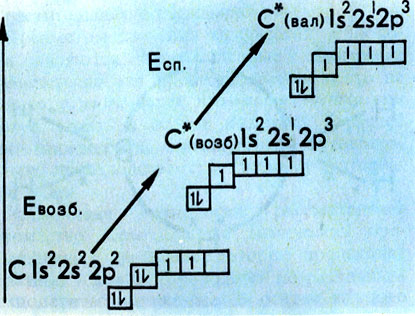
Рис. 4. Переход атома углерода в валентное состояние
Перевод атома в валентное состояние не сводится только к его возбуждению. Атому в молекуле, в отличие от свободного атома, отвечает хаотическое распределение ориентации спинов неспаренных электронов. Учет этого обстоятельства требует добавки к энергии возбуждения атома (Евозб) энергии, связанной с переориентацией спинов (Eсп). Вклад Есп в суммарные затраты энергии, необходимые для перевода атома в валентное состояние (Eвал), весьма заметен и соизмерим с Eвозб. Кроме того, электронные облака атома в молекуле могут быть так или иначе гибридизованы, чему также соответствует определенная энергия (Eгибр). Однако ее вклад в Eвал обычно не превышает 20-60 кДж/моль, и им часто пренебрегают.
Все указанные энергетические затраты на перевод атома в валентное состояние компенсируются энергией, выделяющейся при образовании химических связей. Разумеется, если Eвал очень велика, то она не может окупиться образованием дополнительных связей. Так, у атомов Сu, Ag и Аu Eвал, отвечающая переходу d-электрона на свободную р-орбиталь
(n - 1)d10ns1 → (n - 1)d9ns1np1?
довольно велика и максимальна у серебра. Возможно, с этим обстоятельством связан тот факт, что для Ag наиболее характерно одновалентное состояние, тогда как для Сu и Аu - соответственно двух - и трехвалентное.
Переход атома в валентное состояние - не единственный способ увеличения его валентных возможностей. Дополнительная (2е- - 2ц)-связь может образоваться также, когда один партнер (донор) представляет имеющуюся у него "готовую" пару электронов, а другой (акцептор)-свободную ячейку (орбиталь). Получающаяся полярная ковалентная связь называется донорно-акцепторной. Хорошо известный пример - образование иона аммония:
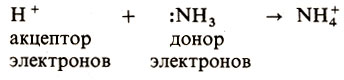
Заметим, что донорно - акцепторная связь отличается от обычной ковалентной связи только своим происхождением, поэтому при рассмотрении "готовой" молекулы не имеет смысла различать эти два типа связи.
Валентные возможности атома могут увеличиваться также путем образования (2е--Зц)-связей. В этом случае два электрона в своем движении "охватывают" три ядра, как, например, в молекуле диборана В2Н6 (рис. 5), где мостиковая связь В-Н-В осуществляется двумя электронами. В молекуле В5Н9 имеется (6е- -5ц) - связь, охватывающая все пять атомов бора. Иными словами, движение электронов не всегда ограничено областью только двух ядер, электроны могут быть делокализованы по всей молекуле или по ее фрагменту (см. Бензол).
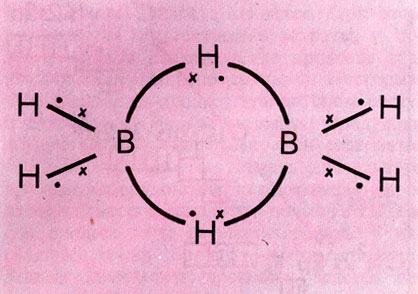
Рис. 5. Химическая связь в молекуле диборана (символ 'х' обозначает электроны атомов бора, символ '·'-электроны водородных атомов)
Несмотря на разнообразие типов химических связей, можно выделить три общих и наиболее важных их свойства. Прежде всего, валентные возможности атомов каждо-го элемента, т.е. его способность образовывать химические связи, строго упорядочены и ограничены, благодаря чему молекулы имеют определенный состав. Иначе говоря, химическое взаимодействие обладает свойством насыщаемости. Это первое важное свойство химической связи. Так, например, есть нейтральные молекулы Н2O, Н2O2, радикалы ОН, O2Н, но нет соединений состава Н3O5, Н7O12 и т.д.
Второе важное свойство химической связи - ее направленность. Так как электронные облака имеют разную форму и ориентацию в пространстве (см. Атом), их взаимное перекрывание может осуществляться различными способами. В зависимости от симметрии образующегося облака перекрывания различают σ- и π-связи. При образовании σ-связи область перекрывания находится на линии связи (рис. 6а); π-связи возникают при перекрывании электронных облаков по разные стороны от этой линии (рис. 66). Пространственное расположение а-связи определяет геометрию молекулы. Часто, однако, химические связи образуются не "чистыми" электронными облаками, характерными для изолированных атомов, а "смешанными" или гибридными облаками атомов. При гибридизации n различных по форме и энергии облаков их первоначальная форма, энергия и ориентация изменяются, и образуются п новых электронных облаков одинаковой формы и энергии, которые ориентированы в пространстве так, чтобы отталкивание между ними было бы минимальным. Иными словами, при гибридизации электронных облаков (орбиталей) атомов происходит как бы "выравнивание" их по форме и энергии.
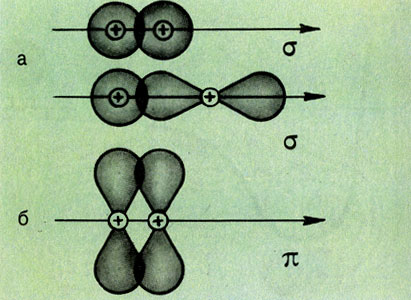
Рис. 6. Способы взаимного перекрывания электронных облаков в пространстве (рис. 6а-σ-связь; рис. 6б-π-связь)
И наконец, третье важное свойство химической связи - ее полярность. Связь между атомами разных элементов всегда в той или иной степени полярна, так как разные атомы имеют различную электроотрицательность. Например, в молекуле НС1 электронная плотность смещена к атому хлора, потому что его электроотрицательность больше, чем у водорода. В результате на атомах образуются эффективные частичные заряды Н+0,18Сl-0,18.
Рассмотренные выше понятия и представления лежат в основе современной теории химической связи. В настоящее время строение молекул и твердых тел методами квантовой механики изучает квантовая химия, представляющая собой одну из интереснейших и бурно развивающихся отраслей науки.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'