
Электрохимия
Электрохимия - раздел физической химии, изучающий процессы переноса тока в электролитах, объемные и поверхностные свойства твердых и жидких тел, содержащих подвижные ионы.
Эта наука зародилась в начале XIX в., когда был создан первый длительно действующий источник постоянного электрического тока - вольтов столб. Но подлинной теоретической основой электрохимии стала теория электролитической диссоциации, созданная в 80-х гг. XIX в.
Электродвижущая сила (ЭДС) в химических источниках тока возникает благодаря химическому взаимодействию веществ. Первые же химические источники тока - вольтовы столбы - помогли открыть и получить в свободном состоянии ряд новых химических элементов - натрий, калий, кальций и др. Позже выяснилось, что с помощью электричества можно получить не только простые, но и сложные вещества и никаким другим способом нельзя непрерывно и в столь широ-ких пределах изменять скорость химических реакций.
В становлении электрохимии как науки важную роль сыграли работы М. Фарадея, Г. Дэви, Р. Клаузиуса, Й. Берцелиуса, Дж. Гиббса, С. Аррениуса, И. А. Каблукова, Р. Герни, А. Н. Фрумкина.
Электрохимические процессы состоят из нескольких стадий: диффузии, миграции (передвижения) заряженных частиц под действием электрического поля, переноса заряда и масс вещества (в виде ионов). Возможно также выделение пузырьков газа, включение освободившихся атомов в "чужие" кристаллические решетки, насыщение поверхности электрода водородом, возникновение в электролите зародышей кристаллизации и т. д.
Аналитической химии электрохимия дала один из широко применяемых методов исследования веществ - полярографию. Качественный и количественный состав исследуемых веществ определяют по зависимости тока от потенциала ртутного капельного электрода. Современные усовершенствованные полярографические методы позволяют установить в миллилитре раствора примеси веществ порядка 10-10г.
Электрохимические методы, использующие измерения ЭДС гальванических элементов, позволяют изучать механизмы, термодинамику и кинетику реакций (см. Кинетика химическая. Термодинамика химическая).
В промышленности с помощью электрохимии разработаны основы производства таких важных продуктов, как сода, хлор, щелочные металлы, алюминий. Широко применяется электрохимическое рафинирование (очистка от примесей) цветных и редких металлов. С помощью электросинтеза получают и новые химические продукты. В наше время большие возможности открылись перед электрохимией в области органического синтеза. Так, с помощью электричества получены многие органические димеры (см. Полимеризация).
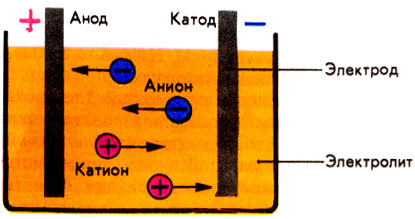
Схема электролиза
Электрохимия помогает также бороться с коррозией металлов, в основном двумя способами: нанесением гальванических покрытий и собственно электрохимически (катодная и анодная защита).
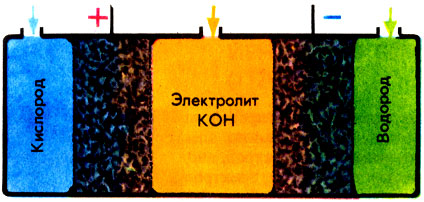
Принципиальная схеам гальванического элемента одноразового действия с щелочным электролитом
Технике и быту электрохимия дала многочисленные химические источники тока - гальванические элементы (батарейки), аккумуляторы, топливные элементы. В гальванических элементах одноразового действия энергия заключена в виде скрытой энергии пространственно разделенных реагентов. Элементы длительного действия делаются обычно с щелочным электролитом и цинковым анодом. Катодом же служат оксиды меди, марганца, ртути. Из аккумуляторов (их, в отличие от батарей, можно многократно подзаряжать и перезаряжать) самые важные - свинцовые (электролит - серная кислота, электроды из свинца и диоксида свинца РbO2). Свинцовые аккумуляторы устанавливают на автомобилях.
Топливные элементы - это те же гальванические элементы, но в качестве анодного реагента в них используется твердое, жидкое или газообразное топливо. Электрохимические реакции - это, как правило, окислительно-восстановительные реакции. Наибольшее распространение получили водородо-кислородные топливные элементы со щелочным электролитом.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'