
Метод Сольве
Уже с начала XIX в. химики пытались найти способ получения соды путем превращения хлорида натрия в карбонат натрия без использования серной кислоты. В 1810 г. А. Фреснель получил соду действием аммиака и углекислого газа на раствор поваренной соли, однако его метод не стал промышленным. По этому же пути пошли в 30-е годы Д. Хэмминг и Г. Дьар. Они тоже пропускали аммиак и углекислый газ в водный раствор поваренной соли. При этом выпадал плохо растворимый бикарбонат натрия NaHCО3, переходивший при нагревании в соду. Для промышленности этот метод оказался нерентабельным, так как не был найден способ регенерации аммиака.
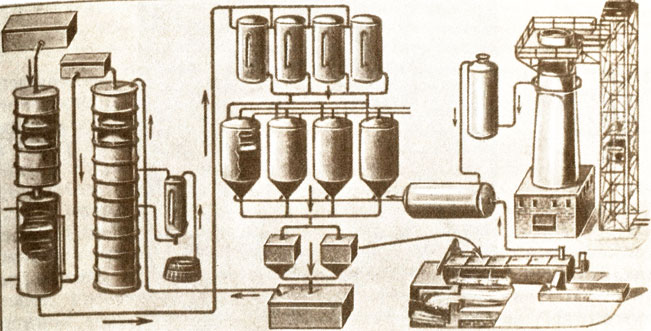
Схема производства соды по методу Сольве (Брокгауз, 1934 г.)
Наконец, Эрнесту Сольве удалось найти способ регенерации аммиака и некоторого количества углекислого газа и сделать весь процесс непрерывным. Сольве сконструировал новое оборудование и машины. В результате многолетних экспериментов он установил оптимальные условия для получения высоких выходов бикарбоната натрия.

Эрнест Сольве (1838-1922)
Отец Эрнеста Сольве был владельцем каменоломни и солеварни в г. Ребеке (около Брюсселя). Эрнест родился в 1838 г. В юности он много болел и свою мечту - занятия химией - вынужден был осуществить только путем самообразования. Позднее Сольве работал на заводе по производству газа, принадлежавшему его дяде, и пытался найти способы утилизации вредных побочных продуктов, образующихся при получении газа (в частности, аммиачной воды). Кроме того, Сольве искал способ получения соды из раствора поваренной соли, аммиака и углекислого газа.
Преимущества разработанного Сольве аммиачного способа получения соды были очевидны. Во-первых, этот метод требовал значительно более низких температур и тем самым обеспечивал экономию угля. Во-вторых, вместо очищенной поваренной соли в этом методе можно было использовать рассолы, стоимость которых была значительно ниже. В-третьих, метод Сольве включал меньше стадий и, что очень важно, при этом не нужна была серная кислота [103, с. 470]. И наконец, метод Сольве не вызывал загрязнения окружающей среды и давал соду очень высокой чистоты. Сравним основные стадии обоих методов.
Производственные стадии по методу Леблана:
1. 2NaCl + H2SO4 = Na2SO4 + 2НСl (при температуре темно-красного каления).
2. Na2SO4 + ЗС + СаО = Na2CO3 + CaS + 2CO (температура до 960° С).
3. Выщелачивание.
4. Выпаривание и кристаллизация Nа2СО3 * 10Н2О.
5. Кальцинирование с образованием Na2CO3.
6 Частичная регенерация серы из сульфида кальция.
Производственные стадии по методу Сольве.
1. NaCl + NH3 + СO2 + Н20 = NaHCO3 + NH4Cl (образование NаНСО3 происходит в водном растворе при 30-40° С).
2. Кальцинирование с образованием соды: 2NaHCO3 = NагСО3 + СО2 + Н2О (СО2 частично остается в замкнутом процессе).
3. Регенерация аммиака: 2NH4Cl + СаО = СаСl2 + Н2O + 2NH3.
Несмотря на преимущества метода Сольве, его автор вначале испытывал большие трудности. Основанная им в 1863 г. вблизи г. Шарлеруа (Бельгия) фабрика истощила все семейные капиталы. Только после создания в 1865 г. акционерного общества "Сольве и К°" продукция, получаемая этим методом, могла успешно конкурировать с предприятиями, работавшими по методу Леблана, а затем и победить их на международном рынке. Вскоре почти во всех странах возникли заводы по производству соды методом Сольве: в Англии (1871 г.), Франции (1874г.), Германии, вблизи Вилена в Бадене (1880 г.) и окрестностях Бернбурга (1883 г.), США (1881г.), России (1883 г.). Подобно Альфреду Нобелю (см. ниже), Сольве стал одним из самых богатых и влиятельных людей в мире. Он основал прекрасно оборудованный исследовательский институт, на своих заводах ввел в 1908 г. трехсменный график работы с восьмичасовым рабочим днем. Монопольное положение владельцев этих предприятий обеспечивало им колоссальные прибыли. Концерн Сольве стал одной из самых могущественных химических компаний.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'