
1. Атомная теория о строении вещества
Еще недавно атомная теория строения вещества только предполагала существование атомов и молекул (наименьших частиц вещества). Теперь для объяснения строения вещества мы пользуемся электронной теорией, основанной на заключениях современной физики; существование атомов и молекул принимается в ней с уверенностью. Чтобы лучше понять современную теорию строения вещества, мы изложим сначала старую теорию и лишь после этого новую. Таким способом мы выделим то, что остается в силе, из того, что нужно считать опровергнутым и заменить новым воззрением.
Согласно атомной теории вещества не заполняют целиком занимаемое ими пространство. Каждое вещество состоит из мельчайших, находящихся друг от друга на небольших расстояниях, совершенно одинаковых частиц, которые называются молекулами. Простым механическим делением до молекул мы дойти не можем. Поэтому молекулы являются предполагаемыми мельчайшими частицами вещества; их невозможно увидеть даже в сильнейший микроскоп.
Ввиду того, что большинство веществ является соединениями двух или более элементов (простых веществ - элементов известно сейчас около 100), каждая молекула соединения состоит из двух или нескольких частиц, еще меньших чем она сама; эти частицы ми называем атомами.
Напр., если представить себе наименьшую частицу HCl, обладающую еще особенностями хлористого водорода, то это будет молекула. Но так как HCl является соединением двух элементов, то значит молекула HCl сложена из двух еще меньших частиц, т. е. из атома Н и атома Cl. Следовательно, каждое количество Cl содержит неисчислимое множество одинаковых молекул HCl, а каждая молекула состоит из атома Н и атома Cl. Из этого можно заключить, что разных видов молекул столько, сколько есть соединений (неорганических около 30 тысяч, а органических почти один миллион), а разных видов атомов столько, сколько есть элементов (около 100). Из этого следует далее, что атомы одноименные (т. е. атомы одинакового атомного числа и веса) имеют одинаковые величины и вес, атомы же разных элементов различаются по величине и весу.
Кроме того атомная теория предполагает, что отдельные атомы при обычных условиях (температуры и давления) не способны существовать, как таковые, но под влиянием химической соединяемости одноименные атомы образуют молекулы элементов, а разноименные атомы - молекулы соединений.
При обычных условиях газообразные элементы содержат двухатомные молекулы (Н2, O2, N2, Сl2 и т. д.), которые только под влиянием высокой температуры или химических сил распадаются на атомы (Н, О, N, Cl). У металлов и редких газов молекулы одноатомные (К, Na, Mg, Са, Fe, Не, Кr), у некоторых неметаллов могут быть и многоатомные (Р4, S8, О3).
Согласно атомной теории основой каждого вещества являются атомы, следовательно:
а) элементы - это вещества, состоящие из одинаковых молекул, из которых каждая состоит из нескольких одинаковых атомов (если только эта молекула не одноатомная);
б) соединения - это вещества, состоящие из одинаковых молекул, из которых каждая состоит из разных атомов;
в) смеси - это вещества, содержащие разные виды молекул.
Наглядно эти понятия изображены на приложенном рисунке (рис. 1), на. котором атомы имеют вид небольших шариков.
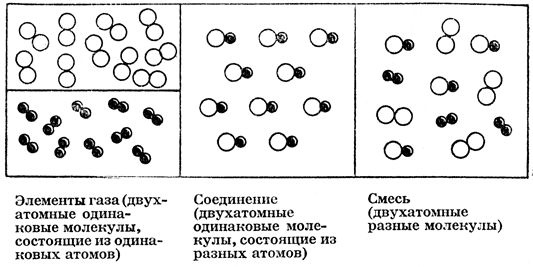
Рис. 1. Схематическое изображение элемента, соединения и смеси
Необходимо еще напомнить, что большое количество веществ состоит не из молекул, а из электроположительных ионов (катионов) и из электроотрицательных ионов (анионов), расположенных в кристаллической решетке. Такие соединения называются ионными соединениями.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'