
11. Электронная теория строения вещества
В продолжение всего прошлого столетия только предполагалось существование атомов и мельчайших частиц далее неделимых. Их действительное существование удалось доказать лишь с помощью современных экспериментальных методов. Открытие радиоактивности особенно способствовало мощному развитию химии, причем пришлось отрешиться от существовавших до тех пор взглядов на неделимость и неизменяемость атома и пополнить науку новыми воззрениями. Также первоначальные представления об атомах, как об упругих шариках, и некоторые представления о соединении атомов в молекулы в свете новых открытий оказались недействительными; было доказано, что атомы - это сложные системы и что все химические изменения вызываются преимущественно действием электрических сил.
Современные исследования вещества показали, что атомы всех элементов являются системами, созданными так наз. элементарными частицами (протоны, нейтроны и электроны). Атомы одного элемента содержат в ядре одинаковое число протонов, атомы же разных элементов различаются между собой числом протонов и их расположением.
Согласно электронной теории строения вещества, атом любого элемента состоит из электроположительного атомного ядра (состоящего из протонов и нейтронов), в котором сосредоточена вся масса атома, и из электронной оболочки электроотрицательных электронов, которые по сравнению с ядром атома почти не имеют массы.* (см. рис. 7).
*(Протон - это положительно заряженная частица размером в 1, нейтрон - частица той же величины без заряда, электрон - частица размером в 1/180 протона.)
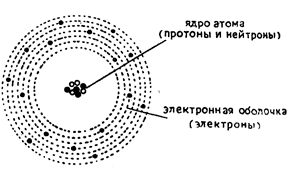
Рис. 7. Схема строения атома
Ввиду того, что атом в целом является электрически нейтральным, то заряд ядра атома будет равен заряду электронной оболочки, т. е. число электронов будет равно числу протонов.
На основании новых открытий в области спектральной физики мы приходим к представлению, что электроны вращаются вокруг ядер атома по определенным энергетически уравновешенным путям (слоям, оболочкам, сферам), которые мы обозначаем (начиная от ядра) буквами К, L, М, N, О, Р и Q (см. табл. 4).
Рис. 8 представляет собой схематическое изображение атомов первых трех периодов периодической системы элементов Менделеева; из него ясно, что самым простым атомом является атом водорода, ядро которого состоит из одного протона, а электронный слой из одного электрона. Ядро атома гелия состоит из двух протонов и двух нейтронов. Его электронный слой составляют два электрона, вращающихся в сфере К. Ввиду того, что гелий - элемент несоединяющийся (с нулевой валентностью), можем считать его сферу К заполненной. Атом лития содержит в ядре три протона, а его электронный слой - три электрона, из которых два находятся в заполненной сфере К, а один в сфере L. У прочих атомов этого периода двух- электронная сфера К остается устойчивой, тогда как сфера дополняется, так что Be имеет в сфере L два электрона, В три, С четыре, N пять, О шесть и F семь электронов. После F следует Ne, который так же как Не не соединяем и поэтому его восемь электронов заполняют сферу L в так наз. октет. Если эти отношения выразить числами, то получится таблица 4.
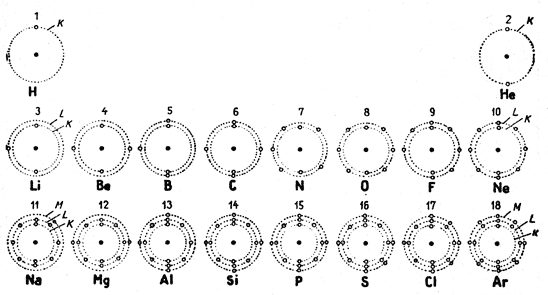
Рис. 8. Строение атомов
У элементов с большими атомными весами отношения все же гораздо более сложные, как это видно из таблицы периодической системы, где число электронов обозначено маленькими цифрами. Химическая соединяемость вызвана электронами внешнего электронного слоя или так наз. валентной сферы, их называют валентными электронами. Если возьмем валентные электроны атомов первых элементов периодической системы, то получим таблицу 5.
Из таблицы следует, что:
а) в каждом периоде число валентных электронов возрастает от элемента к элементу всегда на один электрон, в каждой же группе число электронов одинаково;
Таблица 4

б) у атомов элементов с нулевой валентностью (несоединяющихся) их валентные сферы заполнены (у Не два электрона, у прочих - по восьми электронов) так наз. октетом. Ввиду того, что эти элементы с остальными элементами не соединяются, мы считаем формацию их атомов устойчивой (без энергии).
Из этого следует, что соединяться может только такой элемент, атомы которого не имеют в валентной сфере октета, или если их валентные сферы не заполнены. Атомы с незаполненными валентными сферами меняют свою формацию на устойчивую после того как они соединятся или свяжутся.
Таблица 5
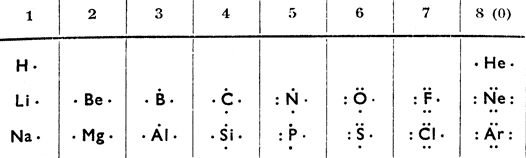
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'