
13. Теория химического соединения
Уже говорилось (гл. 12) о том, что соединяться могут только такие элементы, атомы которых имеют незапол ценные валентные сферы, и что соединение по существу есть изменение атомов с незаполненными валентными сферами в атомы устойчивой формации (дополнение октета). Мы различаем несколько видов связи:
а) связь ионная (ионогенная, гетерополярная, электровалентная).
При этой связи из атомов образуются атомы нейтральные, электрически заряженные - так наз. ионы. Если наглядно изобразить напр. реакцию соединения натрия с хлором (рис. 9), то мы увидим, что в ней примут участие только электроны валентных сфер: атом натрия отдаст свой валентный электрон атому хлора. Атом пополнится в конфигурацию октета (Ne) и станет положительно заряженным ионом, так наз. катионом (Na+). Электрически нейтральный атом Cl приобретает в свою валентную сферу валентный электрон натрия, дополняет конфигурацию октета (Аr) и становится отрицательно заряженным ионом, анионом (Сl-).
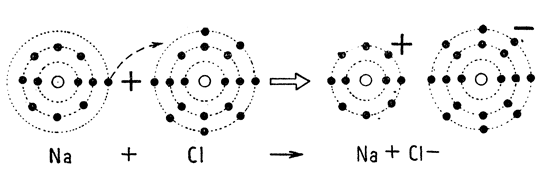
Рис. 9. Схематическое изображение ионной связи
Элементы, способные создавать таким образом катионы, называются элементами электроположительными. Обычно это металлы (и водород). Элементы, способные принимать электроны, называются электроотрицательными. Как правило это неметаллы.
Оба иона (катион и анион) свободно движутся в водном растворе или в сплаве (поэтому водный раствор NaCl и сплав NaCl электропроводны и подвергаются электролизу, т. е. разложению электрическим током), в кристалле же NaCl оба иона удерживаются электростатическими силами в кристаллической решетке. NaCl кристаллизируется в кубической системе, и его кристаллы состоят из мельчайших кубиков, в углах которых находятся попеременно ионы Na+ и Cl-. Внутри кристалла каждый Na+ окружен шестью ионами Cl-, так что нет смысла говорить о молекулах NaCl, ибо весь кристалл является собственно одной громадной молекулой (рис. 14). О молекулах NaCl в смысле атомной теории можно было бы говорить, если бы NaCl был в парообразном состоянии.
Так как в реакции соединения участвуют только валентные электроны, то соединение натрия с хлором мы можем выразить так:
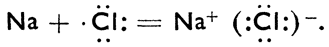
Таким образом можно выразить и другие связи, напр. соединение магния с кислородом:
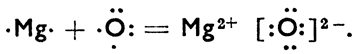
У более тяжелых элементов отношения сложнее.
Эта связь называется ионной связью, она преобладает почти у всех неорганических и органических солей, окислов, сульфидов и т. д. Выражается она так, что вместо обычных формул NaCi, ZnS, FeCl3 и Аl2О3 пишется Na+Cl-, Zn2+S2-, Fe3+Cl3-, Аl3+2O2-3 и т. д. Однако она никогда не обозначается знаком валентности.
Соединения, образованные ионной связью, называются ионными соединениями или электролитами. Ионы могут быть или положительно или отрицательно одновалентными (Na+, Cl-), двувалентными (Mg2+, О2-), трехвалентными и т. д. Положительная валентность выражена следовательно числом валентных электронов, тогда как отрицательная валентность - это число электронов, которые атом может принять для дополнения до устойчивой формации (до октета). Поэтому сумма положительной и отрицательной валентности = 8 (полярность валентности).
Переход нейтральных атомов в ионы связана так наз. электронным сродством. Чем меньше сила связи валентных электронов с ядром (т. е. чем меньше электронное сродство), тем легче они передаются атому другого элемента. Так как легче всего соединяются щелочные металлы (в периодической системе первая группа) с галогенами (седьмая группа), то значит, электронное сродство у щелочных металлов самое малое, а у галогенов самое большое; электронное сродство постепенно падает от F к Li, от Cl к Na и т. д. Два элемента тем легче соединяются, чем больше разница их электронного сродства.
б) Химическая связь (атомная, ковалентная, гомеополярная)
При соединениях элементов, у которых одинаковое или мало отличающееся электронное сродство, атомы соединяющихся элементов достигают устойчивых формаций, т. е. электронного октета; при этом ни один электрон не меняет своего первоначального положения, несмотря на то, что валентные электроны двух разных атомов соединяются в так наз. электронную пару.* Напр.:
*(В сущности в электронной паре одинаково заряженные электроны должны были бы взаимно отталкиваться. Электронная теория приравнивает атомы к планетной системе. Электроны не только вращаются вокруг ядра по определенной орбите, но и сами подвержены вращению, иначе говоря, имеют определенный спин, т. е. вращаются вправо или влево, так что образуют незначительные электромагниты с точно ориентированными полюсами. Электроны с одинаковым (параллельным) спином отталкиваются и остаются изолированными, электроны же противоположного (антипараллельного) спина притягиваются и образуют электронные пары.)
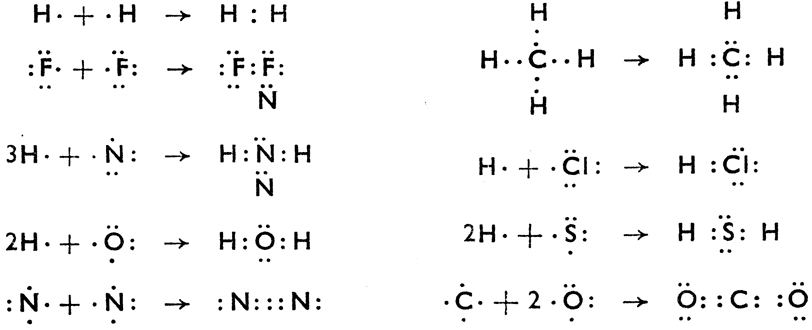
При этой связи, называемой атомной или химической, атомы элементов образуют молекулу соединения, в которой оба электрона электронной пары являются общими. Электронная пара, следовательно, принадлежит обоим атомам и представляет в два раза большую (иногда в три раза большую) конфигурацию октета, - так наз. устойчивую формацию. Современная физика объясняет прочность этой связи тем, что атомы молекулы связаны механическими силами. Пока какая-нибудь внешняя сила их не разделит, они прочно связаны друг с другом как в жидком, так и в газообразном или твердом состоянии.
Из приведенных примеров вытекают так наз. электронные формулы соединений, которыми мы пользуемся редко (только в случаях подробных толкований). Обычно электронная пара выражается черточкой, или, иначе говоря, связью. Далее мы будем говорить о связи простой или кратной, т. е. двойной или тройной, по числу электронных пар, связующих атомы элементов. Чаще всего применяются структурные формулы, обозначающие структуру или внутреннее строение молекул.
Пишутся они так:
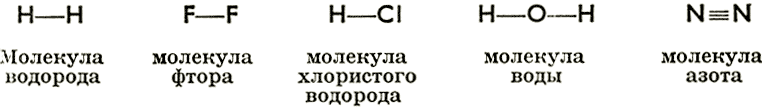
Черточка обозначает электронную пару и выражает здесь атомную связь, поэтому в обозначениях ионных соединений она не применяется.
Электронные формулы показывают, что наряду с так наз. связующими электронными парами в молекуле остаются еще так наз. свободные электронные пары (несвязующие), обозначаемые иногда черточкой и в структурных формулах, следующим образом:
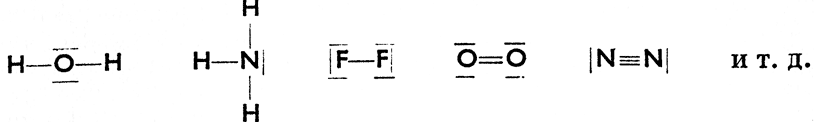
Свободные электронные пары вступают в силу при так наз. координативной связи.
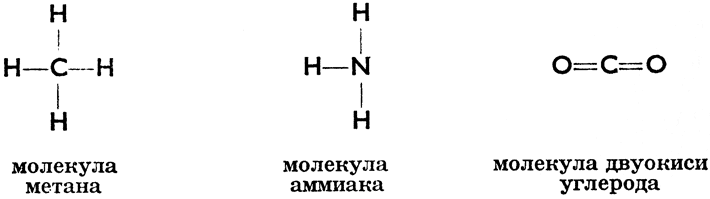
У некоторых элементов преобладает простая связь. Так напр. водород имеет всегда простую (одинарную) связь; это видно из формулы Н-Н, Н-О-Н, NH3, СН4 и т. д. Некоторые элементы (напр. О, N, S, С) способны создавать двойные и тройные связи. Исключительной способностью создавать связи отличается углерод, могущий связывать простыми, двойными и тройными связями не только атомы других элементов, но и другие атомы углерода; это видно из формул:
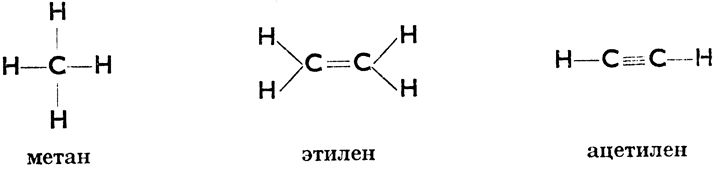
Число электронных пар, которыми атом какого-нибудь элемента связан с атомами других элементов, является числом, выражающим способность к атомной связи. Водород имеет одинарную (атомную) связь, кислород двойную, азот тройную а углерод четырёхкратную.
Нужно помнить, что связывающая способность не имеет ничего общего с валентностью, ибо связывающая способность действительна только для соединений с атомной связью, а валентность для соединений с ионной связью. Напр. в Na+Cl- оба иона одновалентны (Na+ положительно одновалентен, Cl- отрицательно одновалентен), однако связь их нулевая, т. к. они не связаны электронной парой. В молекуле Cl-Cl оба атома имеют одинарную связь, но валентность их нулевая. В Mg2+О2-оба иона двухвалентны, но связь их нулевая. В молекуле О = С - О кислород имеет двойную связь, а углерод четверную, но валентность обоих нулевая.
Соединения, не проводящие электрический ток, так наз. неэлектролиты, обладают особенной способностью к химической связи; таковы аммиак, окислы неметаллов и большинство органических соединений.
Вещества с химической связью образуют молекулярные кристаллы; их решетка состоит из отдельных молекул, которые под действием слабых междумолекулярных сил держатся вместе. Поэтому вещества с молекулярной решеткой (рис. 17) имеют относительно низкую точку плавления (напр. СН4 метан, ССl4 четыреххлористый углерод, С6Н6 бензол, твердый водород, иод и т. д.).
в) Полярная связь
Особый случай химической связи - это полярная связь, о которой можно сказать, что она составляет переход между ионной и химической связями. Соединением атомов образуется здесь молекула, которая проявляется как молекула полярная. Наиболее известными примерами полярной связи будут галогеноводороды (HF, HCl, НВr, HJ), вода, Н2О, и некоторые органические соединения.
Если соединяются атомы с одинаково заряженным ядром, напр. Н-Н, F-F, то электронная пара распределяется равномерно между обоими атомами. Однако, у большинства соединений нужно считаться с неравномерным распределением электронной пары, так как при химической связи двух атомов с неодинаковыми ядрами, электронная пара смещена в сторону того атома, чьи электроны притягивают его сильнее (чье электронное сродство больше). Тогда этот атом становится отрицательным полюсом, а другой положительным, образовавшаяся молекула становится полярной (диполь).
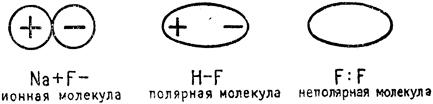
Рис. 10. Схематическое изображение молекул
Приведенные примеры химического соединения показаны на рис. 10.
При реакции соединения азота с водородом получается NH3 (аммиак), причем у атома азота остается несвязующая свободная электронная пара, которая меняется в электронную связующую пару, как только это станет возможным. Напр. под действием хлористого водорода аммиак реагирует согласно схеме:
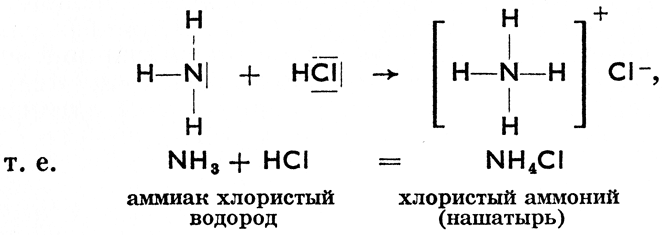
Как видим, катион аммонияNH+4 образуется азотом четырёхкратной связи (возникшим из трехсвязного азота) и четырьмя атомами водорода; он возник присоединением Н+ к свободной электронной паре атома азота, от которого он и получил положительный заряд. Кроме того катион находится в ионной связи с анионом Сl-.
Эта связь, созданная обоими электронами одного только атома, образовавшего связующую электронную пару, называется семиполюсной связью (координативной).
г) Металлическая связь
Особый вид связи дают элементы металлов, которые отличаются большой тепло- и электропроводностью. Ввиду того, что металлы слабо связывают валентные электроны, последние легко переходят в катионы. Наглядно структура металла изображена на рис. 11.

Рис. 11. Металлическая связь
Поэтому металлы считаются ионными соединениями, в которых функцию анионов выполняют свободные электроны, которые легко перемещаются (так наз. электронный газ, перемещающийся между катионами и нейтральными атомами, от которых электроны еще не отделились). В то время как ионные соединения создают хрупкие кристаллы, металлы обладают ковкостью, вызванной силой сцепления катионов металла и свободных электронов. Поэтому электропроводимость металлов объясняется способностью свободных электронов легко перемещаться. Электрический ток является тогда протеканием свободных электронов через металлический про водник.
Как и у ионных соединений молекулой считается простая формация (катион и анион). Предполагается, что молекулы металлических элементов одноатомные (хотя весь кристалл металла образует одну гигантскую молекулу).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'