
2. Экстрактивная перегонка
Частично растворимые двойные смеси. Большинство так называемых несмешивающихся жидкостей, например вода и бензол или вода и хлороформ, в действительности частично в большей или меньшей мере растворимы друг в друге. Если смесь воды и какой-либо жидкости, не смешивающейся с водой, скажем, эфира или бензола, сильно взболтать и дать ей отстояться, то смесь разделится на два слоя: один - насыщенный раствор жидкости в воде, другой - насыщенный раствор воды в жидкости. Состав таких растворов сильно изменяется в зависимости от природы взятых жидких веществ и температуры. Так, например, эфир растворяет воду, образуя раствор, содержащий воды 1,09% при 10° и 1,22% при 20°; бензол также растворяет воду, образуя смесь, содержащую при тех же температурах 0,04 и 0,06% воды. В свою очередь вода растворяет эфир или бензол. В этих растворах, получаемых при тех же температурах, в смеси соответственно содержится эфира 9,0% при 10° и 6,48% при 20°; бензола 0,16 и 0,18% (см. приложение II, табл. 2).
Так как взаимная растворимость жидкостей изменяется с температурой, то при известной температуре гетерогенная до этого смесь жидкостей может стать гомогенной, и наоборот. Классическим примером такой смеси является смесь фенола и воды (подробнее см.1).
Как известно, углеводороды и анилин, нерастворимые друг в друге при комнатной температуре, при повышении последней начинают смешиваться во всех отношениях. Температура, при которой тот или иной углеводород целиком растворяется в анилине, - критическая температура растворения - является характерной для данного углеводорода и зависит от соотношения объемов взятых компонентов. На этом явлении основано, например, определение анилиновых точек.
Такие смеси в еще большей степени отличаются по своим свойствам от идеального раствора, нежели азеотропные. На рис. 73 показана зависимость суммарного давления пара смеси двух частично растворимых даже при температуре кипения смеси жидкостей от ее состава. Вместо максимума, характерного для азеотропных смесей, мы видим на рис. 73 область постоянного давления пара. В пределах концентрации от 0 до а компонент В растворяется в Л; в пределах же состава от b до 1 вещество А растворяется в В.
По мере растворения вещества В в А общее давление пара возрастает до образования насыщенного раствора (х=а), где х - содержание нижекипящего компонента в смеси; то же самое мы наблюдаем при растворении вещества А и В (у насыщенного раствора х=b); увеличение концентрации какого-либо вещества за пределы насыщенного раствора приводит к расслаиванию. При этом состав каждой из жидких фаз уже больше не меняется (растворы насыщенные); изменяется лишь соотношение объема обеих жидких фаз. Поэтому и общее давление, как это видно из рис. 73, и состав пара остаются постоянными в пределах концентрации от х=а до х=b. Поскольку давление пара насыщенных растворов несмешивающихся жидкостей, как видно из рисунка, больше давления пара каждого из компонентов, температура кипения расслаивающейся смеси ниже температуры кипения каждого из взятых веществ в отдельности.

Рис. 73. Влияние состава на давление пара смеси двух частично растворимых жидкостей: 0-а - область растворов вещества В в веществе А; в-1 - область растворов вещества А в веществе В; а-в - область расслаивания. Абсцисса: содержание нижекипящего компонента в жидкости. Ордината: давление пара
Состав пара и температура кипения смеси зависят от давления, что хорошо видно из табл. 12.
В предельном случае, т. е. для совершенно несмешивающихся жидкостей, общее давление пара смеси равно сумме парциальных давлений составляющих ее компонентов. Температуру перегонки подобной двойной смеси легко вычислить, зная зависимость давления пара от температуры для каждого из компонентов. Еще проще определить эту температуру графически (рис. 74). С этой целью на одном графике проводят кривые 1 и 2 зависимости давления пара от температуры обоих компонентов, а затем кривую суммарного давления 3 (для каждой температуры ордината точки на кривой суммарного давления равна сумме ординат соответствующих точек на кривых давлений компонентов). Абсцисса точки из суммарной кривой, ордината которой равна общему давлению, например 760 мм рт. ст., соответствует температуре перегонки смеси (другой метод графического нахождения температуры кипения смеси двух несмешивающихся жидкостей см.4).
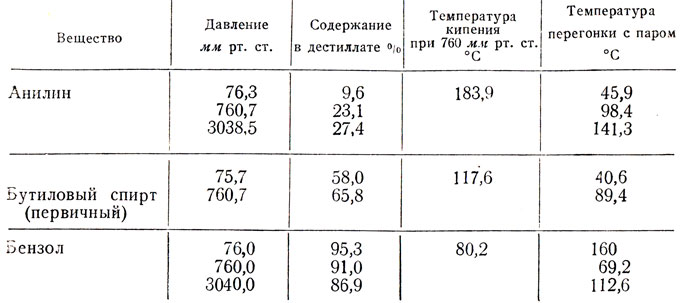
Таблица 12. Зависимость температур кипения и состава пара от давления при перегонке с водяым паром
Характер кривых давления пара смеси частично растворимых жидкостей, которые при повышенных температурах полностью растворяются друг в друге, зависит от критической температуры растворения жидкостей. Если критическая температура растворения меньше темпаратуры кипения нижекипящего компонента, то кривые давления аналогичны кривым обычных растворов. Если критическая температура растворения лежит выше температуры кипения вышекипящего компонента, то кривая имеет форму, характерную для смеси нерастворимых жидкостей. Для смесей, критическая температура растворения которых лежит между температурами кипения компонентов, кривые имеют форму, промежуточную между двумя другими типами кривых. Соответственно этому изменяется и поведение такого рода смесей при перегонке.
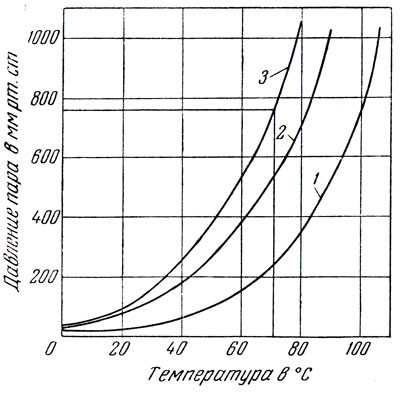
Рис. 74. Графическое вычисление температуры кипения смеси двух взаимно нерастворимых жидкостей (воды и бензола): 1 - кривая давления вещества А (воды); 2 - кривая давления вещества В (бензола); 3 - кривая суммарного давления
Процесс экстрактивной перегонки. При экстрактивной перегонке в головку колонки вводят растворйтель, кипящий значительно выше наиболее высококипящего компонента и не образующий азеотропа ни с одним из компонентов смеси. Растворитель стекает по колонке в качестве составной части флегмы. Смысл добавления растворителя заключается только в том, что он по- разному влияет на изменение давления пара отдельных компонентов смеси. Растворитель должен полностью смешиваться (в пределах применяемых при разгонке температур давлений и составов) со всеми компонентами. При расслоении жидкости в каком-либо месте ректифицирующей части колонки (за исключением конденсатора, холодильника и приемника) пропадает большая часть преимуществ этого метода разгонки. Наоборот, желательно, чтобы добавка отслаивалась в приемнике, что облегчает ее отделение.
Построив серию кривых равновесия только для компонентов исходной смеси и приняв содержание растворителя за параметр, легко убедиться, что роль добавляемого вещества действительно заключается в обоих случаях в увеличении относительной летучести исходной смеси. На рис. 75 показано изменение положения кривой равновесия смеси гептан - метилциклогексан при добавлении анилина (на осях координат отложены составы углеводородной части жидкости и пара).

Таблица 13. Средние величины относительной летучести а смеси гептан - метилциклогексан при добавлении постороннего вещества
С увеличением концентрации анилина в жидкости кривая равновесия становится все более выпуклой, следовательно значение а возрастает. Еще более разительная картина получается при экстрактивной перегонке н-гептана с метилциклогексаном. Чем больше отклоняется исходная смесь от идеального раствора, тем больше вероятности, что ее можно будет разделить перегонкой в присутствии постороннего вещества. Так, например, при отделении толуола от близкокипящих неароматических углеводородов добавление в смесь фенола (50%) повышает относительную летучесть до 2,1 вместо 1,4 для исходной смеси. Это значит, что для выделения толуола из смеси при помощи экстрактивной перегонки с фенолом достаточна колонка эффективностью в 12 ТТ вместо 40 ТТ, необходимых для разделения смеси без добавления фенола. Для смеси гептан - метилциклогексан значение а равно 1,10. Средние величины а этой смеси при добавлении в качестве третьего компонента разных веществ78 приведены в табл. 13.
Для разделения этой смеси требуется колонка эффективностью около 200 ТТ. Приблизительный расчет показывает, что если к смеси добавить 50% мол. анилина, то разделение углеводородов будет достигнуто на колонке эффективностью не менее 70 ТТ, при добавлении же 92% мол. анилина для разделения углеводородов достаточна колонка, эффективностью в 40 ТТ.

Рис. 75. Кривые равновесия смеси н-гептан - метилциклогексан при добавлении анилина: 1 - диагональ; 2 - без анилина; 3 - (мол.) анилина в исходной жидкости; 4 - 78%; (мол.) анилина; 5 - 92% (мол.) анилина
При экстрактивной перегонке углеводородов в качестве добавок рекомендуются анилин, фенол, фурфурол, нитробензол, (β,β' - дихлорэтшювый эфир, т. е. те селективные растворители, которые применяются в нефтяной промышленности для очистки масел. В отличие от азеотропной перегонки при экстрактивной перегонке давление мало влияет на действие добавок. Поэтому при экстрактивной перегонке вполне возможно применять вакуум для понижения температуры кипения смеси.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'