
Распространенность и устойчивость ядер
Распространенность элементов в земной коре колеблется в широких пределах. До начала 30-х годов распространенность элементов геохимики связывали со структурой электронной оболочки атомов. В настоящее время признано, что распространенность зависит от устойчивости ядер. Американский геохимик В. Д. Гаркинс установил, что от первого элемента к последнему распространенность в целом падает приблизительно обратно пропорционально седьмой степени порядкового номера. Однако кривые распространенности носят периодический характер, что связано с типом ядра по массе, четным или нечетным значением Z. На кривых распространенности (см. рис. 16) особое место занимают элементы, ядра которых являются магическими.
К дважды магическим ядрам относятся:
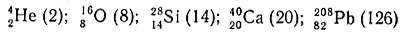
(в круглых скобках проставлено число нейтронов). Попытаемся рассмотреть распространенность этих элементов.
Среди ядер легких элементов ядро 42. Не обладает наибольшей устойчивостью: энергия связи нуклонов составляет около 28 Мэв. Образование этого ядра путем слияния четырех протонов сопровождается выделением колоссальных количеств энергии:
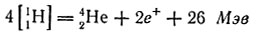
Устойчивость ядер гелия послужила отправным пунктом для гипотезы о гелионном строении ядер, по которой более сложные ядра состоят из некоторого числа ядер гелия (например, ядро 168O можно представить в виде "агрегата", состоящего из четырех альфа-частиц, или гелионов).
Интересно, что при альфа-радиоактивном распаде тяжелых ядер образуется поток альфа-частиц (ядер гелия), не претерпевающих дальнейшего распада, что является дополнительным доказательством особой устойчивости гелия.
Ядра 168O и 2814Si - ядра наиболее распространенных элементов в земной, коре: кислорода - около 50 вес. % (1-е место), кремния - около 26 вес. % (2-е место). В природной смеси этих элементов содержится по три устойчивых изотопа, но на долю дважды магических изотопов приходится основная масса их, соответственно 99,759 и 92,16%.
Сравним распространенность в природе шести устойчивых изотопов кальция (общее содержание кальция в земной коре - 3,6 вес. %):
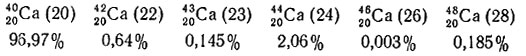
Как видно, наиболее распространенным (96,97%) является изотоп, обладающий дважды магическим числом.
При радиоактивном распаде изотопа тория 23290Th образуется 13 промежуточных радиоактивных изотопов других элементов, но конечным продуктом распада является 20882Рb - устойчивое ядро, характеризующееся двумя магическими числами. К магическим ядрам по числу протонов относятся:
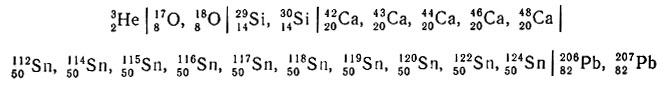
Изотоп 32Не, в сравнении с 42Не, должен быть менее устойчивым (действительно, энергия связи нуклонов в 2,5 раза меньше) и менее распространенным (его в миллион раз меньше).
Перечисленные изотопы кислорода, кремния и кальция, характеризующиеся одним магическим числом, распространены в природе в значительно меньшем количестве, чем их дважды магические изотопы.
Элементы со средними порядковыми номерами отличаются большим числом изотопов в природной смеси, но наибольшее число устойчивых изотопов характерно для олова (в смеси 10 изотопов), обладающего магическим числом 50.
Конечными продуктами распада радиоактивных семейств урана 23892U и актиноурана 23592U являются изотопы свинца (206Рb и 207Рb), отличающиеся устойчивостью и магическим числом 82.
К магическим ядрам по числу нейтронов относятся следующие устойчивые ядра:
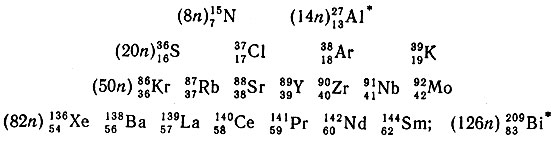
Следует особо отметить ядра алюминия и висмута (отмечены звездочкой). Единственный нечетный элемент с субмагическим числом 14 - А1 обладает большой распространенностью - его содержание в земной коре составляет 7,45 вес. %; по распространенности он занимает третье место, уступая в этом отношении лишь кислороду и кремнию. Висмуту отвечает магическое число 126 и, как отмечалось выше, он последний элемент в периодической системе, для которого известен устойчивый изотоп. Этот изотоп 20983Вi является конечным продуктом распада радиоактивного семейства нептуния - 23793Nр, все члены которого по своей массе относятся к типу 4n + 1.
Элементы Y, Nb, и Рr являются моноизотопными элементами, имеющими по одному устойчивому изотопу. Большим содержанием в смеси отличаются изотопы нечетных по Z элементов: 3919К (93,3%) и 13957Lа (99,91%). У четных по заряду ядер элементов с Z = 40 ÷ 82, содержание наиболее распространенного изотопа в смеси не превышает 35%, за исключением изотопов 138Ва и 140Се, содержание которых достигает соответственно 71,66 и 88,49%, что, несомненно, связано с их магическим числом, равным 82. Содержание наиболее легких стабильных изотопов обычно не превышает 2%, но у изотопов с магическими числами 50 или 82 (90Zr, 92Mo и 144Sm) содержание в смеси повышается (соответственно до 51,46, 15,86 и 3,16%).
Изотопы серы, хлора, аргона, криптона и ксенона (36S, 37Cl, 38Аr, 86Кr и 136Хе), характеризующиеся магическими числами по n, являются устойчивыми, а изотопы этих элементов, отличающиеся от указанных массовыми числами (на единицу меньше или больше), относятся к бета-радиоактивным, т. е. ядра их неустойчивы.
Пока ничего определенного нельзя сказать о связи магического числа с распространенностью изотопов азота.
Из всего вышесказанного следует, что наиболее распространенными являются "четно-четные" ядра, а среди них те, которым отвечают определенные магические числа. Кривая распространенности в логарифмической шкале для четных ядер расположена в среднем на 1/2 - 1 порядок выше, чем для нечетных, а максимумы приходятся на ядра с магическими числами (рис. 16).
Радиоактивные изобары соседних элементов в системе в результате β+- и β--распада превращаются в наименьший по массе (m) устойчивый изобар, называемый 2β-устойчивым. Например, для изобаров элементов с Z = 32 ÷ 36 и массовым числом 77 схема превращения может быть записана так:
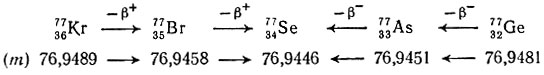
Эти β+- и β--превращения протекают самопроизвольно, так как радиоактивный процесс сопровождается выделением энергии и, следовательно, уменьшением массы.
Некоторые ученые считают, что проблема устойчивости и распространенности изотопов в природе должна рассматриваться не только с учетом магических чисел, но и закономерности образования 2β-устойчивых изобаров. Это позволяет объяснить несоответствия в последовательности величин атомных весов элементов в периодической системе и должна приниматься во внимание при разработке периодической системы ядер.
Для s-, р- и d-элементов номера групп периодической системы приобретают новое значение. В четных группах располагаются элементы с четным Z, а в нечетных группах - с нечетным Z. Единственным исключением будут нечетные элементы 27Сo, 45Rh и 77Ir, если их размещать, как еще принято, в VIII группе.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'