
§ 1. Электролиты и неэлектролиты
Вы познакомились с двумя видами химической связи: ковалентной - на примере соединений неметаллов друг с другом, и ионной - на примере соединений неметаллов с металлами. Но вам известны соединения более сложного состава: гидроокиси металлов, соли кислородных кислот. Каков вид химической связи в них?
В гидроокисях и солях имеются оба вида связи. Атомы элементов гидроксила и кислотных остатков связаны друг с другом ковалентными связями, а между металлами и гидроксилом или металлами и кислотными остатками связь ионная. Таким образом, кристаллы щелочей и солей кислородных кислот, подобно солям бескислородных кислот, например Na+Cl-, слагаются из ионов. Положительно заряжены в них ионы металла, а отрицательно заряжены ионы гидроксила и ионы кислотных остатков. Ионами, таким образом, могут быть не только заряженные атомы, но и заряженные группы атомов.
Заряды ионов гидроксила и ионов кислотных остатков, как и ионов металлов, численно равны их валентности: ОН-, NO3-, SО42-, PО43-. Поэтому формулы оснований и солей кислородных кислот мы можем представлять в следующем виде: Na+(OH)-, Ca2+(OH)2- Na+(NО3)-, Al23+(SO4)32-.
Следует ожидать, что вещества с ионными связями будут и по свойствам отличаться от веществ с ковалентными связями. Это подтверждается изучением электропроводности растворов веществ с ковалентными и ионными связями с помощью прибора, изображенного на рисунке 1. Прибор представляет собой два угольных стержня, присоединенных проводами к штепселю. К одному из проводов подключена электрическая лампочка. Если вставить штепсель в розетку осветительной сети, лампочка не засветится, потому что цепь не замкнута, между стержнями имеется зазор. Но если прикоснуться . концами стержней к металлическому предмету, цепь замкнется и лампочка ярко засветится.
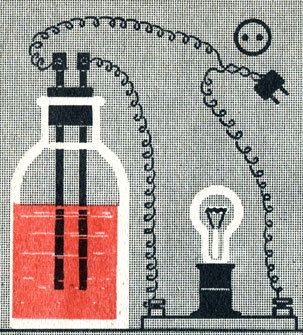
Рис. 1. Прибор для испытания электропроводности жидкостей
Погрузим концы стержней в дистиллированную воду. Лампочка не засветится, цепь останется разомкнутой. Значит, чистая вода электрического тока не проводит. Погрузим концы стержней в сухую поваренную соль. Лампочка не засветится, твердая соль тоже не проводит тока. Но, если щепотку поваренной соли растворить в дистиллированной воде и погрузить стержни в полученный раствор, лампочка ярко засветится. Раствор соли, в отличие от самой соли и воды, хорошо проводит электрический ток. Подобно поваренной соли, ведут себя другие соли, щелочи и кислоты. Взятые в отдельности вода, соли, щелочи и чистые кислоты тока не проводят. Но водные растворы кислот, щелочей и солей проводят электрический ток.

Вещества, растворы которых проводят электрический ток, называются электролитами. Соли, кислоты и щелочи - электролиты. Соли и щелочи, в отличие от кислот, проводят ток не только в растворе, но и в расплавленном состоянии.
Если подвергнем такому же исследованию растворы в воде веществ, в молекулах которых имеются лишь ковалентные неполярные или малополярные связи, например, растворы кислорода, спирта, сахара, то убедимся, что лампочка при погружении стержней прибора в такие растворы не засветится: эти растворы не проводят электрический ток.

Вещества, растворы которых не проводят электрический ток, называются неэлектролитами.
Кислород, спирт, сахар - неэлектролиты.

- Какие вещества называются электролитами, неэлектролитами?
- Вещества каких классов относятся к электролитам?
- Какие из перечисленных веществ и смесей электропроводны: а) сжиженный хлористый водород, б) раствор хлористого водорода, в) расплавленный едкий натр, г) раствор иодида калия?
- С помощью прибора, изображенного на рисунке 1, испытайте, проводит ли ток: а) дистиллированная вода, б) водопроводная или колодезная вода, в) дождевая вода. Чем объясняется электропроводность одной из исследуемых вод?
- Воспользовавшись прибором для обнаружения электропроводности растворов, найдите способ обнаружения растворимых солей в почве, взятой с пришкольного участка или из цветочного горшка.
- Из каких ионов слагаются кристаллы: а) сульфата калия, б) сульфата алюминия, в) гидроокиси кальция? Одинакова ли сумма зарядов положительных и отрицательных ионов в каждом случае?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'