
§ 3. Механизм электролитической диссоциации
Почему диссоциация электролитов происходит в воде и не происходит, например, в керосине? Чтобы ответить на этот вопрос, нужно ближе познакомиться со строением молекулы воды. Она образуется путем присоединения к атому кислорода двух атомов водорода за счет спаривания двух неспаренных р-электронов атома кислорода с неспаренными электронами атомов водорода. Электронные облака, образованные р-электронами, имеют вытянутую, гантелеобразную форму, и оси их взаимно перпендикулярны, поэтому два атома водорода присоединяются к атому кислорода так, что их связи образуют между собой угол около 100° (рис. 2). Эти связи сильно полярны, электронные пары в них смещены к атому кислорода, и молекулу воды можно рассматривать как ион кислорода, к которому присоединены два протона. При погружении ионного кристалла в воду молекулы воды притягиваются своим отрицательным полюсом - ионом кислорода - к положительным ионам, выступающим на поверхность кристалла (рис. 3). Точно так же протоны притягиваются отрицательно заряженными ионами кристаллической решетки. Разъединяя разноименные ионы, молекулы воды во много раз ослабляют их притяжение друг к другу. Кристалл растворяется: он как бы растаскивается молекулами воды на ионы.
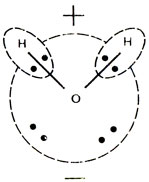
Рис. 2. Форма молекулы воды
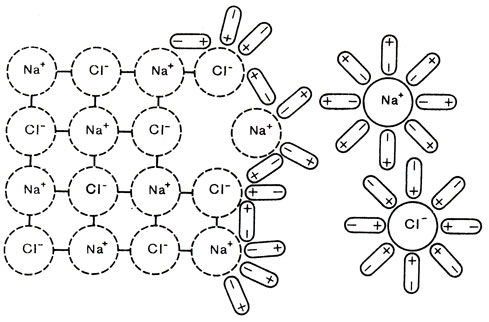
Рис. 3. Схема электролитической диссоциации хлорида натрия
Разумеется, молекулы воды, притянувшиеся к ионам при растворении кристалла, остаются связанными с ними и в растворе. Поэтому ионы, содержащиеся в растворе, не те ионы, которые содержались в кристаллической решетке. Так, вам известно, что безводный сульфат меди CuSО4 бесцветен: значит, бесцветны и ионы Сu2+ и SO42-, из которых слагается его кристаллическая решетка. Лишь присоединяя при растворении молекулы воды, ионы Сu2+ приобретают голубую окраску, свойственную растворам солей меди*. Эта голубая окраска принадлежит, таким образом, гидратированным, т. е. связанным с молекулами воды, ионам меди.
* (Чтобы отличить гидратированные ионы, содержащиеся в растворах электролитов, от негидратированных ионов, содержащихся в кристаллах, иногда заряды гидратированных ионов изображаются: точками (..) положительные, а штрихами (') отрицательные, например Сu.. вместо Сu2+, SO4" вместо SO42-.)
Точно так же при диссоциации кислот ионы Н+ не просто отрываются от их молекул, а связываются с молекулами воды:
Н++Н2O = Н3O+
Ион Н3O+ называется ионом гидроксония.
Таким образом, электролитическая диссоциация кислот обусловливается перемещением ионов водорода из молекул кислоты в молекулы воды, например:
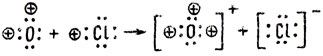
(кружок с крестиком здесь обозначает протон Н+).
Электроотрицательный атом кислорода, содержащийся в молекуле воды, сильнее притягивает протон, содержащийся в молекуле кислоты, чем кислотный остаток Сl-. Поэтому ион водорода отщепляется от молекулы кислоты и присоединяется к атому кислорода через одну из двух свободных электронных пар. Таков механизм превращения ковалентной связи в молекулах кислот при взаимодействии их с водой в ионную связь.
Кристаллогидраты некоторых кислот имеют ионную кристаллическую решетку, слагающуюся из положительно заряженных ионов гидроксония и отрицательно заряженных ионов кислотного остатка, например:
НСlO4*Н2O = (Н3O) + (СlO4)-
Подобно ионам водорода, в растворах электролитов все ионы гидратированы, т. е. связаны с молекулами воды. Но впредь молекулы воды, присоединившиеся к ионам, мы не будем учитывать, так как в химических реакциях электролитов они обычно не участвуют.

- Что такое электролитическая диссоциация? Какое участие принимает в ней вода?
- Чем отличаются ионы, содержащиеся в кристаллической решетке хлорида натрия, едкого натра, от ионов, содержащихся в растворах этих веществ?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'