
§ 21. Взаимодействие азота с водородом
Реакция между азотом и водородом N2 + 3H2 2NH3 имеет весьма примечательную историю. Многие ученые на протяжении всего XIX в. пытались осуществить эту реакцию, используя все методы, которыми владели тогда химики: нагревали исходные вещества, пропускали через их смесь электрические искры, пытались ускорить реакцию, подыскивая для нее катализаторы. Однако все эти усилия не приводили к сколько-нибудь заметному успеху. Это сейчас легко объяснить, зная, что молекулы азота очень прочны. Лишь в начале XX в., после того как получила развитие теоретическая химия, удалось выяснить условия протекания этой реакции.
2NH3 имеет весьма примечательную историю. Многие ученые на протяжении всего XIX в. пытались осуществить эту реакцию, используя все методы, которыми владели тогда химики: нагревали исходные вещества, пропускали через их смесь электрические искры, пытались ускорить реакцию, подыскивая для нее катализаторы. Однако все эти усилия не приводили к сколько-нибудь заметному успеху. Это сейчас легко объяснить, зная, что молекулы азота очень прочны. Лишь в начале XX в., после того как получила развитие теоретическая химия, удалось выяснить условия протекания этой реакции.
Приступим к изучению этой реакции, познакомившись предварительно с ее течением в лабораторной установке (рис. 8). Азот и водород смешаем в соответствии с уравнением реакции в объемных отношениях 1:3 (приближенно о соотношении объемов подаваемых в аппарат газов можно судить, пропуская их через жидкость - концентрированную серную кислоту).
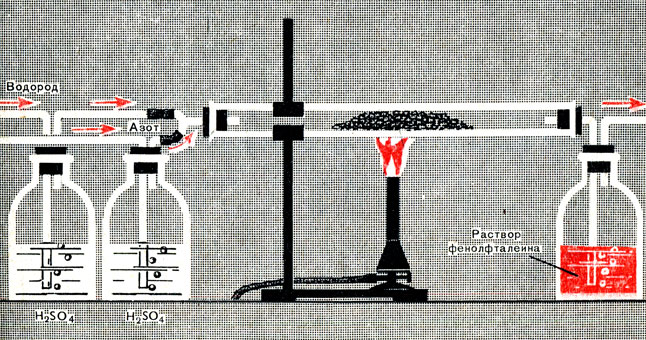
Рис. 8. Лабораторная установка для синтеза аммиака
Газовая смесь проходит через стеклянную трубку и присоединенную к выходному отверстию трубки склянку с раствором фенолфталеина. Изменение окраски раствора укажет, что аммиак образуется. Сначала будем пропускать смесь через пустую трубку без нагревания. Опыт показывает, что при комнатной температуре и атмосферном давлении - реакция не идет. Изменим условия реакции - будем нагревать проходящую через трубку азотоводородную смесь. Реакция не идет и при повышенной температуре.
Проверим, не является ли реакция каталитической. Поместим в трубку кусочки железа и вновь будем пропускать через трубку азотоводородную смесь при обычной температуре - реакция не идет. Подогреем теперь трубку - фенолфталеин окрашивается. В присутствии железа при повышенной температуре образуется аммиак. Значит, данная реакция - каталитическая.
Количественное определение содержания аммиака в выходящей из трубки газовой смеси показывает, что при 400°С, атмосферном давлении и в присутствии катализатора содержание аммиака в ней не превышает 0,4 объемных процента. Сколь долго ни находится азотоводородная смесь при этих условиях, содержание аммиака не увеличивается.
Вы уже знаете, что этот результат свидетельствует об обратимости реакции. Чтобы подтвердить этот вывод экспериментально, нужно попытаться провести обратную реакцию:
2NH3 = N2 + 3H2
Пропустим через трубку с тем же катализатором при той же температуре аммиак. Он почти полностью разлагается на азот и водород. Выходящий из трубки газ загорается от пламени спички, это горит образовавшийся водород. Количественные измерения показывают, что содержание аммиака в образующейся смеси в точности то же, что и в смеси, полученной при синтезе аммиака, т. е. 0,4 объемных процента. Следовательно, равновесие при 400°С и атмосферном давлении смещено в сторону азота и водорода.
Реакция азота с водородом - экзотермическая реакция. Следовательно, равновесие смещается в сторону образования аммиака при понижении температуры. Однако, как известно, реакция протекает с достаточной скоростью только при повышенной температуре. Не влияет ли изменение давления на равновесие этой реакции?
Мы не можем в школьной лаборатории провести реакцию при повышенном давлении, но, обратившись к данным, полученным исследователями, мы узнаем, что равновесие зависит от температуры и давления (табл. 6). Как видно из этих данных, равновесие синтеза аммиака смещается в сторону образования аммиака при повышении давления. Обратим внимание на то, как меняется объем газовой смеси при синтезе аммиака: из уравнения реакции видно, что объем уменьшается вдвое.
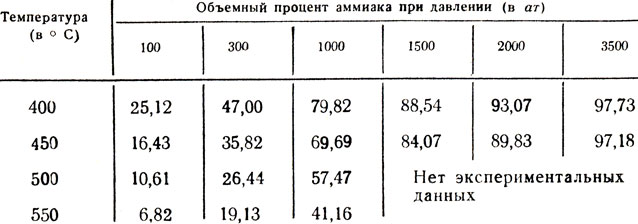
Таблица 6. Объемный процент аммиака в равновесии со смесью азота и водорода (1 объем N2 на 3 объема Н2)
Здесь проявляется общая закономерность смещения равновесия:
если реакция идет с уменьшением объема, то при, повышении давления равновесие смещается в сторону образования продуктов реакции;
если реакция идет с увеличением объема, то при повышении давления равновесие смещается в сторону исходных веществ.
Из данных, приведенных в таблице, видно, что даже при очень высоких давлениях не удается полностью сместить равновесие в сторону образования аммиака. Но нельзя ли применить более активный катализатор, на котором реакция шла бы достаточно быстро при более низких температурах, чем 400°С? Этот вопрос привлекает внимание многих исследователей в течение десятков лет в связи с большим значением его для промышленности. Число веществ (различных металлов, их сплавов и других), испытанных как катализаторы данной реакции, исчисляется, вероятно, многими десятками тысяч, но пока проблемы не удалось решить.

- Реакция синтеза аммиака достигла состояния равновесия. За 1 сек в А реагирующей смеси образуется, предположим, 1 млрд. молекул аммиака. Сколько за это же время расходуется молекул азота, молекул водорода? Сколько распадается молекул аммиака? Сколько образуется новых молекул водорода, азота? Заполните таблицу 7. Убедитесь, что состав смеси не изменился. Сколько молекул аммиака распадается в этой смеси в течение следующей секунды?

Таблица 7 - Вы получите более наглядное представление о зависимости равновесия реакции синтеза аммиака от температуры и давления, если изобразите ее графически. Выполните два графика: на одном покажите, как изменяется равновесный выход аммиака при повышении давления при температуре 400°С и при температуре 550°С, на другом - изменения выхода аммиака при повышении температуры и давлениях, например 100 ат и 1000 ат.
- Пользуясь графиком, определите, каков равновесный выход аммиака при 100 ат и 200°С.
- Сколько водорода и азота расходуется на образование 1 кг аммиака? Результаты выразите в килограммах и в литрах (при н. у.).
- Как смещается равновесие:
2SО2 + О2при повышении давления?
 2SО3 + Q
2SО3 + Q
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'