
§ 27. Азотная кислота
Безводная азотная кислота - непрочное соединение. Она разлагается уже при обычных условиях с образованием двуокиси азота:
4HNО3 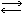 4NO2 + O2 + 2H2O - Q
4NO2 + O2 + 2H2O - Q
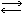 4NO2 + O2 + 2H2O - Q
4NO2 + O2 + 2H2O - QВыделяющаяся двуокись азота частично растворяется в азотной кислоте и окрашивает ее в желтый цвет.
С водой азотная кислота смешивается в любых отношениях. Водные растворы азотной кислоты более стойки к нагреванию, чем чистая кислота. В водных растворах азотная кислота диссоциирует на ионы:
HNO3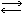 H+ + NO3-
H+ + NO3-
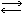 H+ + NO3-
H+ + NO3-Это сильная одноосновная кислота.
Подобно другим кислотам, она реагирует с окислами металлов и основаниями с образованием соли и воды, например !окисью меди с образованием нитрата меди:
CuO + 2HNО3 = Cu(NО3)2 + H2О
или в сокращенном ионном виде ...?
Но с металлами азотная кислота реагирует иначе, чем другие кислоты. При взаимодействии азотной кислоты водород не выделяется. Восстанавливается в ней азот за счет понижения окислительного числа с 5 по низшего значения, вплоть до 3-. Если азотная кислота концентрированная, то, независимо от вoсстановителя, азот восстанавливается до того или иного низшего положительного по знаку значения окислительного числа, вместо водорода образуются двуокись или окись азота - N4+O22- или N2+O2-. Если же кислота сильно разбавленная, а металл химически активный, то азот восстанавливается до окислительного числа 0, т. е. выделяется свободный азот N2, или 3-. В этом последнем случае азот переходит в аммиак N3-H3+, который с избытком кислоты образует нитрат аммония.
Поместим, в круглодонную колбу обрезки медной проволоки. Прильем немного концентрированной азотной кислоты и слегка нагреем. Мы наблюдаем образование газа - бурой двуокиси азота: азотная кислота восстанавливается до двуокиси азота, а медь окисляется до окиси меди. Эта реакция окислительно-восстановительная. Окись меди тотчас же реагирует с азотной кислотой, как указано выше, в колбе образуется водный раствор голубого цвета, характерного для гидратированных ионов меди.
Уравнение окислительно-восстановительной реакции таково:
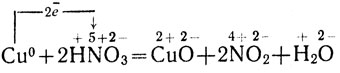
Окись меди реагирует с избытком азотной кислоты:
CuO + 2HNО3 = Cu(NО3)2 + H2О
Суммарное уравнение реакции:
Cu + 4HNО3 = Cu(NО3)2 + 2NО2 + 2H2О
Концентрированная азотная кислота реагирует таким образом и с металлами, которые в электрохимическом ряду напряжения расположены после водорода - с медью, ртутью, серебром. Только золото и платина не реагируют с ней. Однако концентрированную азотную кислоту (96-98-процентную) хранят и перевозят в алюминиевых цистернах. При обычной температуре такая кислота не взаимодействует и со сталью.
Как объяснить эти явления, противоречащие данным о сильном окислительном действии азотной кислоты на металлы?
На поверхности алюминия и железа образуется под действием концентрированной азотной кислоты тонкий слой окисла металла, не реагирующий с азотной кислотой высокой концентрации.
В зависимости от концентрации и от восстановителя азотная кислота при окислении ею других веществ может восстанавливаться до любого низшего значения валентности, или окислительного числа, вплоть до 3-. До какой степени будет восстанавливаться азот, зависит, в первую очередь, от концентрации азотной кислоты, а во вторую - при сильно разбавленных растворах - от химической активности восстановителя:

Если окислительное число сохраняет положительный знак, азот остается связанным с кислородом в окисел соответствующего состава, если оно становится равным нулю, азот выделяется в свободном виде, а если становится отрицательным, азот связывается с водородом в аммиак, который в свою очередь соединяется с избытком азотной кислоты в нитрат аммония.

Рис. 17. Горение лучинки в азотной кислоте
Азотная кислота, особенно концентрированная, окисляет и многие другие вещества, кроме металлов. Если погрузить в концентрированную азотную кислоту тлеющую лучину, то лучина разгорается ярким .пламенем (рис. 17). Скипидар при соприкосновении с концентрированной азотной кислотой воспламеняется (рис. 18). Опилки, стружки также воспламеняются при попадании на них концентрированной азотной кислоты.

РИс. 18. Воспламенение скипидара в азотной кислоте
Концентрированная азотная кислота взаимодействует с белковыми веществами, образуя соединения ярко-желтой окраски. Вследствие этого на коже под действием кислоты образуются желтые пятна. Кислота разрушает шерсть и натуральный шелк.
При работе с азотной кислотой необходимо соблюдать крайнюю осторожность, не проливать ее, не допускать попадания кислоты на кожу, на одежду.
- Опишите: а) физические, б) химические свойства азотной кислоты. Приведите уравнения характерных реакций.
- Как влияет изменение температуры и давления на равновесие реакции разложения азотной кислоты?
- Как реагирует гидроокись меди с раствором азотной кислоты? Напишите полное и сокращенное уравнение этой реакции.
- В трех склянках без надписей находятся соляная,серная и азотная кислоты. Какие химические реакции следует провести, чтобы обнаружить, в какой склянке какая кислота содержится? Напишите уравнения реакций.
- Какой элемент выступает в качестве окислителя при взаимодействиях азотной кислоты с металлами?
- * Назовите соль, состав которой может быть выражен формулой H4O3N2.
- Напишите уравнения реакций следующих превращений: N2→NO→NO2→HNO3→Cu(NO3)2.
- Напишите уравнения реакций взаимодействия разбавленное азотной кислоты с магнием, при которых азот восстанавливается до окислительного числа: а) 0, б) 3-.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'