
§ 60. Зависимость свойств водородных соединений неметаллов от зарядов и радиусов ионов
При изучении неметаллов мы уделяли особое внимание их водородным соединениям, особенно для них характерным. Теперь рассмотрим зависимость свойств этих соединений от положения элемента в периодической системе (таблица 11). Атом водорода может и принимать (Н + 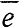 = Н-) и отдавать электрон (Н -
= Н-) и отдавать электрон (Н - 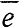 = Н+).
= Н+).
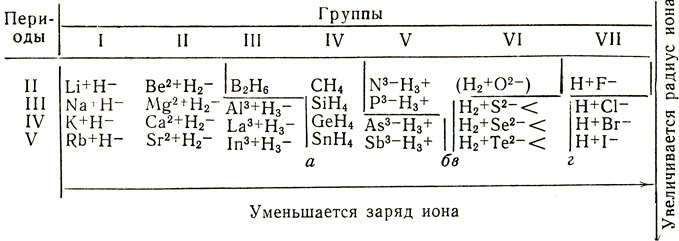
Таблица 11
Соединения, в которых водород электроотрицателен и содержится в виде ионов Н-, как все ионные соединения, нелетучи и тугоплавки. Такие соединения называются гидридами (сравните: хлориды, бромиды, сульфиды, нитриды). Наиболее резко выраженные металлы, соединяясь с водородом, образуют гидриды, например, Li+H-, Са2+Н2-.
В соединениях с наиболее типичными неметаллами водород электроположителен. Такие соединения, например Н+Сl-, Н2+O2-, H2+S2-, имеют молекулярную решетку, поэтому они легкоплавки и летучи, в обычных условиях это газы или летучие жидкости (вода). Что водород в них электроположителен, нагляднее всего проявляется в том, что молекулы галогеноводородов, сероводорода в водном растворе отщепляют положительно заряженные ионы водорода, диссоциируя как кислоты:
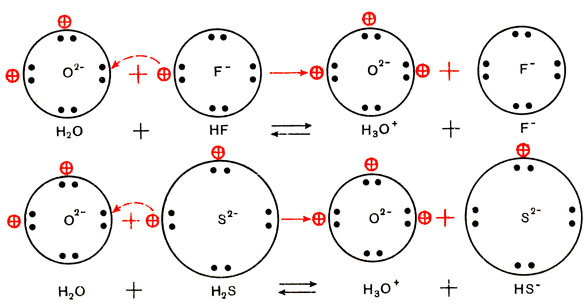
Молекулы водородных соединений неметаллов могут не только отщеплять, но и присоединять протоны за счет свободных электронных пар у атома содержащегося в них неметалла. Это мы видели на примере аммиака и то же самое свойство ранее обнаружили у молекул воды при растворении в ней кислот. Вспомним реакцию аммиака с водой (см. схему на стр. 48). Почему же при растворении в воде фтористого водорода протоны перемещаются от молекул растворяющегося вещества к молекулам воды, а при растворении аммиака наоборот? Ведь в обоих случаях свободные (неразделенные) электронные пары имеются и в молекулах растворяемого вещества, и в молекулах растворителя.
Молекулу Нn+Хn- можно представить как ион Хn-, к которому за счет связующих электронных пар присоединено n протонов. На примере высших кислородных кислот мы убедились: протоны тем сильнее удерживаются ионом кислотного остатка, чем больше его заряду и чем меньше радиус. То же самое проявляется в водородных соединениях неметаллов.
Радиусы ионов неметаллов одного и того же периода (например, N3-, О2-, F-) мало разнятся друг от друга, радиусы же ионов неметаллов одной и той же группы (например, О2-, S2-, Se2-) возрастают с возрастанием порядкового номера неметалла. У ионов N3-, О2- и F- - элементов одного и того же периода - почти одинаковые радиусы, но разный заряд. Трехзарядный ион азота, содержащийся в молекуле аммиака, сильнее удерживает свои протоны и сильнее притягивает добавочный протон, чем двухзарядный ион кислорода, содержащийся в молекуле воды. Поэтому при растворении аммиака в воде протоны из молекул воды перемещаются в молекулы аммиака. А однозарядный ион фтора, содержащийся в молекуле фтористого водорода, слабее удерживает свой протон и притягивает добавочный протон, чем двухзарядный ион кислорода в молекуле воды. Поэтому при растворении фтористого водорода в воде протоны перемещаются от молекул фтористого водорода к молекулам воды.
Рассмотрим теперь, что происходит при растворении в воде сероводорода. У ионов элементов одной и той же группы О2- и S2- одинаковый заряд (оба двухзарядны), но разные радиусы: радиус иона серы гораздо больше, чем радиус иона кислорода. Поэтому протоны в молекуле H2S слабее связаны, чем в молекуле воды, и сероводород, подобно фтористому водороду, диссоциирует как кислота.
Оказывается, механизм электролитической диссоциации аммиака и кислот один и тот же. Он заключается в перемещении протонов от молекул, слабее удерживающих их, к молекулам, сильнее притягивающим. Но результат получается разный: в одном случае раствор приобретает щелочную, а в других - кислую реакцию.
Таким образом, свойства водородных соединений неметаллов, как и свойства их гидратов окислов, зависят от зарядов и радиусов ионов. Это наглядно представлено в таблице 11. Водородные соединения в ней размещены в таком же порядке, как размещены образующие их элементы в периодической системе. Рассекающие таблицы линии последовательно - слева направо -отграничивают: а - гидриды металлов от летучих водородных соединений неметаллов, б - водородные соединения неметаллов с малой полярностью связей от соединений с высокой полярностью, в - водородные соединения, реагирующие с водой с образованием щелочи или с кислотами с образованием солей (NH3 и РН3), от водородных соединений, реагирующих с водой с образованием кислот, г - слабые кислоты от сильных кислот.
В периодах с возрастанием порядкового номера гидриды сменяются сначала водородными соединениями с малой полярностью связей, совсем не взаимодействующими ни с водой, ни с кислотами, ни со щелочами (подобно безразличным окислам), затем водородными соединениями, реагирующими с водой с образованием щелочи (см. III период), слабой кислоты, сильной кислоты (во II периоде таковая отсутствует).
В соответствии с изложенным выше водородные соединения, расположенные левее воды - аммиак и фосфористый водород, реагируют с водой с образованием основания, а расположенные правее и ниже - с образованием кислоты. Сильными из безкислородных кислот являются лишь галогеноводородные, за исключением фтористоводородной кислоты, из-за малого заряда и больших радиусов анионов.

- Почему соединения водорода с металлами нелетучи, а с неметаллами летучи?
- Почему валентности металлов по кислороду и по водороду выражаются одними и теми же числами?
- Проследите, как изменяются свойства водородных соединений элементов с возрастанием порядкового номера элемента: а) в III периоде, б) в V периоде.
- Как и почему изменяется сила бескислородных кислот с возрастанием порядкового номера неметалла: а) в периодах, б) в группах? Какая из них самая сильная?
- Гидриды, растворяясь в воде, реагируют с нею с выделением водорода, например:
LiH + H2О = LiOH + H2↑Изобразите эту реакцию в ионной форме. Разберите ее как окислительно-восстановительную реакцию. Что в ней окисляется? Что восстанавливается?
- Изобразите реакцию между газообразными аммиаком и иодидом водорода подобно тому, как выше представлены реакции взаимодействия с водой аммиака и фтористого водорода (см. стр. 117), но учтя, что продукт реакции получается не в растворенном, а в твердом (кристаллическом) состоянии.
- *Почему температура, при которой начинается возгонка галогенидов аммония (NH4F, NH4Cl и др.), с возрастанием порядкового номера галогена резко возрастает? (Указание: предварительно составьте уравнение реакции, учитывая, что исходное вещество находится не в растворенном, а в твердом (кристаллическом) состоянии по образцу решения задачи 6.)
- Даны одинаковые объемы растворов сульфида натрия и селенида натрия одинаковой концентрации (в молях на литр). В каком из них содержится больше ионов гидроксила? (Указание: составьте предварительно уравнения гидролиза обеих солей.)
- * В отличие от аммиака, фосфористый водород РН3 образует соли, соединяясь только с сильными кислотами и только в отсутствии воды, так как в растворе эти соли нацело подвергаются гидролизу. Почему фосфин так отличается от аммиака? (Указание: учтите различие размеров радиусов ионов азота и фосфора.)
- В растворе содержатся по 1 молю серной и селеновой кислоты. Каких ионов в растворе больше: HSO4- или HSeO4-?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'