
§ 73. Хром
Химический знак - Сr. Порядковый номер - 24.
Атомный вес - 52. Строение атома: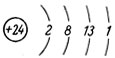
В качестве представителя металлов, относящихся к побочным подгруппам периодической системы, рассмотрим хром: он возглавляет побочную подгруппу VI группы. Его название происходит от греческого слова "хрома" - краска: все соединения хрома имеют яркие окраски. При химических реакциях атом хрома может отдавать, кроме электрона внешнего слоя, до 5 электронов (сверх восьми) предпоследнего слоя.
Хром - металл, по внешнему виду похожий на сталь. Он один из самых твердых металлов (царапает стекло), на воздухе совершенно не изменяется.
Хром проявляет валентности 2+, 3+ и 6 + .
На примере хрома проследим, как влияет изменение валентности металла на свойства его соединений.
С возрастанием валентности хрома его ионный радиус уменьшается:
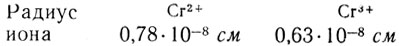
как у элементов одного и того же, например, третьего периода:
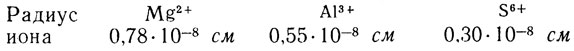
Обратим внимание на близость численных значений радиусов Сr2+ и Mg2+, Сr3+ и Аl3+, Сr6+ и S6+.
С возрастанием валентности и уменьшением ионного радиуса элемента основные свойства его гидрата окисла должны ослабляться, а кислотные усиливаться. Это мы и наблюдаем на гидратах окислов хрома:
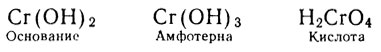
подобно тому как:
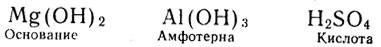
Хром образует три ряда соединений:
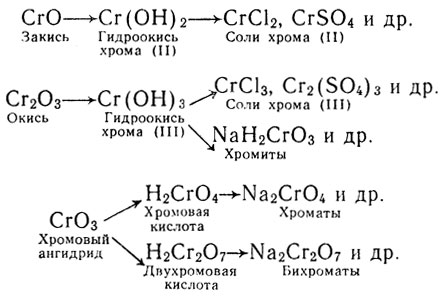
Познакомимся с важнейшими из этих соединений. При растворении хрома в кислотах получаются соли, в которых хром двухвалентен, например:
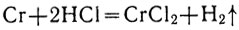
Соединения двухвалентного хрома сходны по составу и свойствам с соединениями магния; гидроокись хрома (II) является основанием.
Окись хрома Сr2O3 нерастворима в воде, зеленого цвета.
Она кристаллизуется в решетке с таким же строением, как решетка окиси алюминия и подобно ей отличается высокой твердостью и тугоплавкостью. Окись хрома, как и окись алюминия, амфотерна.
В природе встречаются прозрачные кристаллы окиси алюминия, в которых часть ионов алюминия замещена ионами трехвалентного хрома, придающими кристаллу красную окраску. Такие кристаллы называются рубинами. Они ценятся как драгоценные камни. Из рубинов изготовляются миниатюрные подшипники часовых механизмов. Искусственные рубины производятся сплавлением окиси алюминия с небольшим количеством окиси хрома.
Гидроокись хрома (III) Сr(ОН)3 выпадает в виде слизистого осадка зеленого цвета при приливании к раствору соли трехвалентного хрома раствора щелочи:
CrCl3 + 3NaOH = Cr(OH)3↓ + 3NaCl
или в ионной форме ...?
Гидроокись хрома, подобно гидроокиси алюминия, амфотерна. Она растворяется в растворах кислот, вновь образуя соли трехвалентного хрома зеленовато-фиолетового цвета (окраска гидратированных ионов Сr3+) и в растворах щелочей, образуя хромиты - соли зеленого цвета (окраска ионов Н2СrО3-):
Сr(ОН)3 + 3НСl = СrСl3 + 3Н2O
Cr(OH)3 + NaOH = NaH2CrO3 + H2O
Соли трехвалентного хрома сходны с солями алюминия по составу, строению кристаллической решетки и по растворимости.
Окисел шестивалентного хрома СrО3 является ангидридом. Соединяясь с водой он образует две кислоты: хромовую Н2СrO4 и двухромовую Н2Сr2O7. Соли первой, например Na2CrO4, желтого цвета (окраска анионов СrO42-), они называются хроматами; соли второй, например Na2Cr2O7, оранжевого цвета (окраска анионов Сr2O72-), они называются бихроматами. Хроматы и бихроматы переходят друг в друга при добавке к раствору кислоты или щелочи.
Таким образом, гидрат окисла шестивалентного хрома Н2СrO4 является уже кислотой: в шестивалентном состоянии хром как бы уподобляется шестивалентной сере. Так, при прибавлении к растворам солей хромовой кислоты солей бария выпадает в виде желтого осадка нерастворимый в воде хромат бария:
Na2CrO4 + BaCl2 = BaCrO4 + 2NaCl
или
CrO42- + Ba2+ = BaCrO4
С возрастанием валентности металлов с переменной валентностью свойства их гидратов окислов изменяются так же, как в периодах периодической системы: от основных через амфотерные к кислотным. При этом при одинаковой валентности и близких размерах ионы разных металлов образуют соединения, сходные не только по составу, но и по свойствам.
Рассмотрим теперь реакции, при которых валентность хрома изменяется. При переходах Сr2+→Сr3+→Сr6+ ион хрома отдает электроны, т. е. окисляется, а при обратных переходах Cr6+→Cr3+→Cr2+ захватывает электроны, т. е. восстанавливается, выступая сам в качестве окислителя. Окислительные свойства проявляют все соединения, в которых содержится хром в шестивалентном состоянии: хромовый ангидрид, хромовые кислоты и их соли. Так, аммиак сам собою загорается при соприкосновении с хромовым ангидридом:
2Cr6+O3 + 2N3-H3 = Сr23+O3 + N20 + 3H2O
Для демонстрации этой реакции вместо хромового ангидрида можно взять истолченный в порошок бихромат аммония (NH4)2Cr2O7. Достаточно прикоснуться к кучке этой соли нагретой стеклянной палочкой, чтобы получилось подобие вулканического извержения: летят искры, носится в воздухе "пепел", и маленькая кучка соли разрастается в вулканическую "гору" с "кратером" на вершине. Она состоит из чрезвычайно рыхлого и тонкого порошка окиси хрома. Так получается окись хрома для полирования изделий из металлов и других материалов до зеркального блеска. Упрощенно реакцию можно представить следующим образом.
При прикосновении нагретой палочки бихромат аммония, как все аммонийные соли при нагревании, разлагается на аммиак и двухромовую кислоту:
(NH4)2Cr2O7 = 2NH3 + H2Cr2O7
Двухромовая кислота в свою очередь разлагается на воду и хромовый ангидрид:
Н2Сr2O7 = 2СrО3 + Н2O
а хромовый ангидрид реагирует с аммиаком, как указано выше. Окислительные свойства солей хромовых кислот ярче всего проявляются в кислой среде. При добавке к раствору какого-либо бихромата кислоты оранжевая окраска раствора .не меняется; но если вслед за тем сюда же прилить раствор любого восстановителя, например сульфита, то оранжевая окраска, свойственная ионам Сr2O72-, тотчас сменяется зеленовато-фиолетовой, свойственной гидратированным ионам трехвалентного хрома:
Na2Cr26+O7 + 3Na2S4+O3 + 3H2SO4 = Cr23+(S6+O4)3 + 3Na2S6+O4 + 4H2O

- Сопоставьте свойства соединений трехвалентного хрома и алюминия шестивалентного хрома и шестивалентной серы.
- Как осуществить переходы: нитрат хрома (III) → гидроокись хрома (III) хромит калия → сульфат хрома (III)? Изобразите реакции ионными уравнениями.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'