
§ 79. Коррозия металлов
Изделия из металлов и их сплавов, кроме золота и платины, под действием воздуха, дождей, почвенной влаги могут разрушаться, образуя соединения, устойчивые к окружающей среде. Особенно сильному химическому воздействию подвергаются металлы в аппаратах химической промышленности: здесь на металл действуют кислород, кислоты, щелочи и другие вещества, часто при высоких температурах и повышенных давлениях.
Разрушение металлов и сплавов вследствие химического взаимодействия с окружающей средой называется коррозией (от латинского слова "корродере" - разъедать).
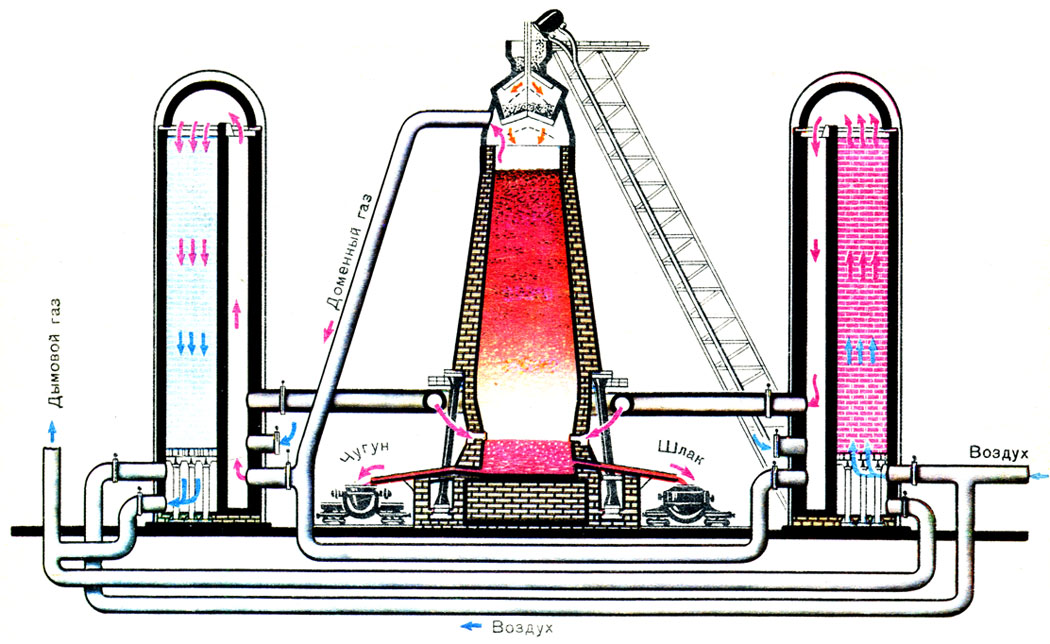
Доменное производство
В результате коррозии качество изделия и сооружений ухудшается. Они могут стать даже совершенно непригодными к использованию. При громадном и все возрастающем количестве 1 машин и металлических сооружений, применяемых в промышленности, в сельском хозяйстве и на транспорте, огромное значение имеет предохранение их от коррозии. Удлинение срока службы машин и сооружений увеличивает мощь нашего социалистического государства, ускоряет его продвижение по пути к коммунизму. Поэтому постоянная борьба с коррозией представляет собой исключительно важную задачу. Но чтобы бороться с коррозией, нужно знать, как она протекает.
Коррозия металлов - это окислительно-восстановительный процесс, при котором атомы металла окисляются и переходят в ионы, например:
Fe - 2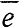 = Fe2+
= Fe2+
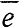 = Fe2+
= Fe2+Сu - 2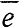 = Сu2+
= Сu2+
 = Сu2+
= Сu2+Что способствует и что препятствует коррозии? Выяснцм эти вопросы путем опытов, привлекая те сведения о ржавлении железа, которые вы получили ранее.
Коррозия железа происходит, как нам известно, при участии кислорода и воды. Поместим железный гвоздь в пробирку, наполним ее доверху водой и опрокинем, зажав отверстие пальцем, в сосуд с водой, после чего вытесним воду из пробирки кислородом. Таким же образом заготовим другие пробирки с такими же гвоздями, но вместо воды в пробирки и сосуды, в которые они будут опрокинуты, нальем раствор поваренной соли. В одном случае к этому раствору добавим немного раствора едкого натра. К одному из гвоздей заранее прикрутим медную проволоку, к другому - полоску цинка. Спустя примерно сутки мы увидим картину, представленную на рисунке 64. На нем указано, что погружено (железо, находящееся в контакте с цинком, с медью) и в какой раствор погружено (в воду, в раствор поваренной соли, без добавки или с добавкой едкого натра). О том, как протекала коррозия в каждом случае, вы можете судить по количеству израсходованного кислорода, т. е. по поднятию уровня жидкости в пробирке и по характеру осадившегося в воде продукта коррозии.
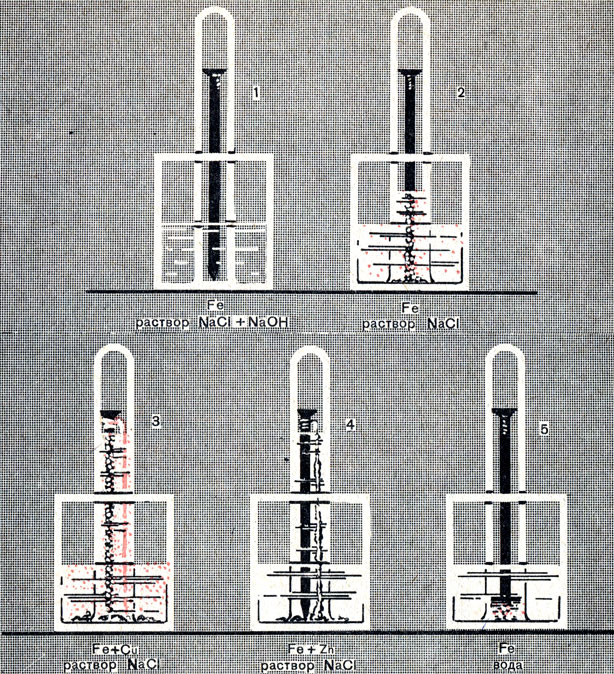
Рис. 64. Коррозия металлов
Сравним результаты опытов 2 и 3. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с медью, а в другом - нет. И там и здесь произошла коррозия и осадился бурый осадок гидроокиси железа (III). Но в опыте 2 ржавчины получилось мало, а в опыте 3 - много. Соответственно этому и расход кислорода в опыте 2 был мал - уровень раствора в пробирке поднялся невысоко, в опыте 3 - велик. Таким образом, коррозия, или ржавление железа резко усиливается, когда оно соприкасается с медью.
Сравним теперь результаты опытов 2 и 4. В обоих случаях железо находилось в одном и том же растворе, но в одном случае оно соприкасалось с цинком, а в другом - нет. Наблюдается сильная коррозия: много израсходовалось кислорода и получился обильный осадок. Но в опыте 2 осадок бурого цвета, это ржавчина. А в опыте 4 осадок получился чисто-белого цвета. Белый осадок - это гидроокись цинка. Следовательно, в опыте 4 корродировало не железо, а цинк. Таким образом, железо практически не корродирует, если оно соприкасается с цинком.
Усиление коррозии в первом случае и прекращение во втором объясняется возникновением гальванических элементов. Так, при соприкосновении железа с цинком возникает гальванический элемент, в котором цинк, как более активный металл, будет окисляться, переходя в ионы Zn2+, а отщепляющиеся от его атомов электроны будут перетекать на поверхность железа и восстанавливать ионы водорода, содержащиеся в омывающем металл растворе. Водород на поверхности железа либо выделяется в свободном виде, либо его атомы, не успев сцепиться в молекулы, окисляются растворенным в воде кислородом в воду. Обычно происходит последнее.
При соприкосновении железа с медью тоже возникает гальванический элемент, но в нем будет окисляться в качестве более активного металла железо. На поверхности обоих металлов и в соприкасающемся с ними слое раствора происходят следующие реакции:
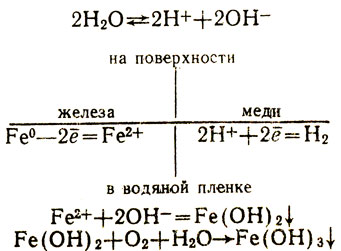
Коррозия металла резко усиливается, если он соприкасается с каким-либо другим менее активным металлом, т. е. расположенным в электрохимическом ряду напряжений правее его. Но коррозия резко ослабляется, если металл соприкасается с другим металлом, расположенным левее в электрохимическом ряду напряжений, т. е. более активным.
Сравним результаты опытов 1 и 2. Добавка к воде поваренной соли усилила коррозию железа - получилось много ржавчины и много израсходовалось кислорода. Добавка к раствору поваренной соли едкого натра, как видно из опыта 5, наоборот, ослабила коррозию - ржавчины получилось мало и кислорода израсходовалось немного.
Таким образом, скорость коррозии данного металла зависит, во-первых, от того, соприкасается или нет этот металл с каким-нибудь другим металлом и каким именно, а во-вторых, от состава омывающей металл среды
Одни составные части омывающей металл среды, в частности ионы хлора, усиливают коррозию металлов, другие составные части могут ослаблять коррозию. Так, коррозия железа ослабляется в присутствии ионов гидроксила.
В приморских местностях коррозия металлических сооружений идет энергичнее, чем вдали от моря. Это объясняется присутствием в морской воде ионов хлора. Брызги морской воды, испаряясь, выделяют в воздух кристаллики растворенных в морской воде солей, а эти кристаллики, растворяясь в водяной пленке на металлах, доставляют в нее ионы хлора.
Теперь мы можем понять широко используемые на практике способы предупреждения коррозии, борьбы с нею.
Чем больше разнятся друг от друга по химической активности два соприкасающихся металла, тем сильнее корродирует o более активный из них и тем надежнее защищен от коррозии второй, менее активный металл. Поэтому недопустимо, например, наличие в конструкции из алюминиевого сплава деталей из меди и ее сплавов (см. положение алюминия и меди в электрохимическом ряду напряжений). Если же таких вредных контактов в конструкции нельзя избежать, то стараются обезвредить эти контакты, например, нанесением на них лакокрасочных покрытий. Защитным действием более активных металлов на менее активные пользуются для предохранения от коррозии подземных трубопроводов и корпусов судов. К трубопроводам присоединяют, а с борта судна при длительных стоянках опускают в воду слитки из сплавов металлов, расположенных близко к началу ряда напряжений - магния или цинка.
Для предохранения металлических изделий от коррозии их изолируют от внешней среды, покрывая лаками, красками, смазками, защитными слоями других металлов. Покрытие должно быть стойким в данной среде, достаточно плотным и иметь хорошее сцепление с металлом.
В некоторых случаях скорость коррозии можно значительно снизить, введя в действующую жидкую среду в небольшом количестве вещества, способствующие образованию на поверхности металла защитной пленки. Такие вещества называют ингибиторами - замедлителями коррозии. Наибольшее применение нашли органические замедлители коррозии. Введение их, например, в соляную кислоту позволяет хранить и перевозить ее в стальной таре вместо хрупких стеклянных бутылей. Соляная кислота с добавкой ингибитора нашла применение для очистки котлов от накипи и очистки поверхности металлов от ржавчины и окалины. Окислы металлов в ней растворяются, а металл не растворяется. Воду, поступающую в паровые котлы, обезвреживают, удаляя из нее растворенный кислород.

- Как изменится течение коррозии в опыте 4, если в пробирку будет помещена такая же полоска цинка, но не связанная с железом? Ответ мотивируйте.
- Перечислите известные вам способы борьбы с коррозией металлов.

Составьте опись предметов, обслуживающих вас дома, в которых применены металлы и сплавы. В каждом случае укажите, как связано данное применение металла с его физическими свойствами. Не забудьте включить в перечень такие предметы, как зеркало, медицинский термометр, электрическую лампочку. Отметьте случаи коррозии этих предметов, если они наблюдались.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'