
2. Сущность химической реакции в свете атомно-молекулярной теории
Формирование понятия о сущности химической реакции может начинаться только в теме "Первоначальные сведения о строении и составе веществ", где учащихся знакомят с атомно-молекулярным учением. Для успешного формирования этого понятия нужно: 1) ,изучить реакции разложения и соединения и выяснить их сущность в свете молекулярной теории; 2) рассмотреть, как происходит при химической реакции превращение молекул одних веществ в молекулы других; 3) закрепить понятие о сущности реакции при разборе новых примеров и выявить, что при химических превращениях сохраняются химические элементы; 4) ознакомить учащихся с уравнением химической реакции; 5) систематически использовать при дальнейшем изучении химических превращений, уравнения реакций и словесную оценку сущности химических явлений.
При изучении реакции разложения на примерах разложения окиси ртути и основной углекислой меди у учащихся могут возникнуть неправильные представления о том, что она происходит только при нагревании, поэтому необходимо ознакомить их и с разложением воды.
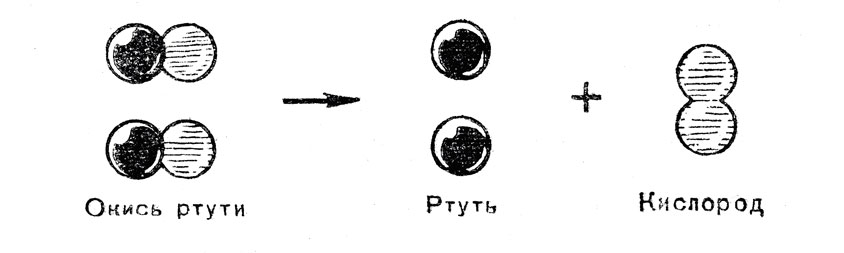
После проведения каждой реакции записывают ее схему. Для разложения окиси ртути она будет такой:
окись ртути → ртуть + кислород.
Сравнение этих схем позволит выявить общее, что характеризует реакции разложения, и дать определение: "Химическая реакция, при которой из одного вещества получается два или несколько новых веществ, называется реакцией разложения". Отмечают, что в свете молекулярной теории - это такая реакция, при которой из молекул какого-либо одного вида получаются молекулы двух или нескольких различных видов.
В целях накопления материала для развития знаний об энергетической стороне химических реакций при разложении окиси ртути, основной углекислой меди и воды внимание учащихся обращают на то, что с прекращением нагревания или действия тока эти реакции прекращаются.
Разлагая воду, указывают на соотношение объемов получающихся при реакции газов водорода и кислорода (2:1).
Затем формируют понятие о реакции соединения, используя реакции железа, цинка, алюминия с серой.
Перед проведением первого опыта учащиеся знакомятся со свойствами железа и серы (отношение к воде, соляной кислоте и магниту), исследуют их смесь. Делают вывод, что при смешивании сера и железо сохраняют свои свойства.
Для дальнейшего формирования понятия об определенности весовых отношений реагирующих веществ проводят два опыта: нагревают смесь серы и железа, взятых в весовом отношении 4:7, и смесь с избытком серы. При разборе первого опыта внимание обращают на образование нового вещества (проба с соляной кислотой) и на выделение теплоты и света. Второй опыт показывает, что реакция идет и при избытке серы, но она не вся вступает в реакцию. Чтобы доказать, что сера осталась, пробирку, в которой произошло взаимодействие, следует снова нагреть, держа несколько наклонно, отверстием книзу. Тогда не прореагировавшая сера расплавится и будет стекать по стенкам пробирки в подставленный сосуд (фарфоровую чашку или тигель).
В дополнение проводят опыт соединения серы с цинком или серы с алюминием, причем отмечают, что 2 вес. ч. цинка соединяются с 1 вес. ч. серы, а 9 вес. ч. алюминия с 16 вес. ч. серы. Записывают схемы проведенных реакций. Формулируют вывод: "Химическая реакция, при которой из двух или нескольких веществ получается одно новое вещество, называется реакцией соединения. В свете молекулярной теории реакция соединения- такая реакция, при которой из молекул двух или нескольких различных видов получаются молекулы одного нового вида".
Для развития и закрепления знаний о характерных особенностях реакции соединения обсуждается вопрос, чем отличается реакция соединения серы с железом от их смешивания. Результаты обсуждения этого вопроса могут быть записаны в таблице.

После изучения реакций разложения, соединения и формирования понятий о простых и сложных веществах у учащихся обычно возникают вопросы: что происходит с молекулами веществ при разложении и соединении, почему простые вещества нельзя разложить, а сложные можно. Эти положения выдвигают как проблемы для дальнейшего изучения химии.
Рассматривая еще раз реакцию разложения окиси ртути, учитель предлагает ответить на вопрос, что про- исходит с молекулами этого вещества. Молекулы окиси ртути при реакции разлагаются на частички ртути и частички кислорода, которые образуют молекулы ртути и молекулы кислорода. Такие же рассуждения проводят относительно одной из реакций соединения.
Затем отмечают, что частицы, из которых состоят молекулы, называют атомами. Атомы в молекулах находятся в непрерывном движении. Очень часто для возникновения реакции необходимо нагревание, оно вызывает увеличение скорости движения не только молекул, но и атомов, из которых состоят молекулы. При ускоренном движении атомов связи между ними ослабевают, а это способствует распаду молекул исходных веществ на атомы, которые группируются по-другому в молекулы новых веществ.
Когда у учащихся сформировано первоначальное понятие о химическом элементе, учитель изображает на доске схему реакции разложения окиси ртути:
Затем обсуждают вопросы о том, превращаются ли при химической реакции атомы одного химического элемента в атомы другого химического элемента, изменяется ли при химической реакции число атомов. Учащиеся приходят к выводам, что, поскольку при химической реакции происходит образование новых молекул из тех атомов, из которых-состояли молекулы исходных веществ, здесь нет ни превращения одних элементов в другие, ни изменения числа атомов.
Понятие о сохранении элемента (атома) при химических реакциях закрепляется при наблюдении и разборе химических опытов: 1) получения окиси меди накаливанием на воздухе порошкообразной меди, 2) восстановления меди из ее окиси водородом.
Учащимся показывают, что при накаливании меди на воздухе она чернеет. Учитель объясняет это явление, записывает схему:
медь + кислород → окись меди
и спрашивает, как доказать, что медь, как химический элемент, при этом превращении не исчезла. Для доказательства демонстрирует реакцию окиси меди с водородом и предлагает записать ее в виде схемы:
окись меди + водород → вода + медь.
Получение восстановленной меди убеждает учащихся в сохранении элемента меди при химической реакции.
Взаимодействие окиси меди и водорода сразу же используют для формирования понятия о реакции замещения. Обращают внимание учащихся на то, что в данном случае из двух веществ получается два вещества. Следовательно, это химическое превращение не может быть ни реакцией соединения, ни реакцией разложения. Оно относится к другому типу реакции, которая называется замещением и характеризуется тем, что при взаимодействии сложного и простого вещества образуются новые вещества: сложное и простое. Сущность реакций замещения в том, что атомы элемента, образующего простое вещество, замещают атомы одного из элементов, входящих в состав молекул сложного вещества, а атомы элемента, вытесненного из сложного вещества, образуют новое простое вещество.
После выяснения, что такое химическая формула, учащихся знакомят с химическим уравнением.
Понятие о химическом уравнении учитель дает при рассмотрении какой-нибудь известной химической реакции. Лучше всего использовать разложение окиси ртути. Чтобы напомнить, как происходит эта реакция, полезно снова ее продемонстрировать и записать схему на доске.
Необходимо отметить, что такая запись не показывает, какое весовое количество окиси ртути вступило в реакцию и какие весовые количества новых веществ образуются. Гораздо удобнее будет запись химической реакции с помощью формул веществ. Под схемой реакции на доске приводят формулы веществ:
окись ртути → ртуть + кислород
HgO → Hg + О2
Но такая запись противоречит закону сохранения массы веществ*, так как масса веществ, записанных в правой части уравнения, будет больше массы веществ, записанных в левой его части. Чтобы убедить .в этом учащихся, проводится соответствующий подсчет: одна молекула окиси ртути составляет 217 к. е., а одна молекула ртути и одна молекула кислорода - 233.
* (Как показано ниже (стр. 26), первое понятие о законе сохранения массы веществ следует дать уже в I теме VII класса.)
Если судить по записи HgO → Hg + O2, то число атомов кислорода в результате разложения как бы увеличилось. Однако этого не может быть, так как при химической реакции молекулы новых веществ образуются из атомов, которые входили в состав молекул, взятых для реакции веществ. Учащиеся решают, сколько молекул окиси ртути должно разложиться для образования одной молекулы кислорода, если в этой молекуле содержится два атома кислорода. Перед формулой окиси ртути ставят коэффициент. Аналогично решают вопрос и о коэффициенте перед формулой ртути.
Только после того как запись приобретает вид:
2HgO = 2Hg + O2,
между правой и левой ее частями ставят знак равенства. Цифры перед формулами называют коэффициентами, а их записывание-расстановкой коэффициентов.
Еще раз повторяют последовательность составления уравнения химической реакции и напоминают, что она показывает: 1) какие вещества вступают в реакцию и какие получаются, 2) каковы молекулярные соотношения реагирующих и получающихся веществ.
На основании уравнения химической реакции можно проводить расчеты. Для примера учитель использует сначала взаимодействие цинка и серы, составляет уравнение реакции. Под формулами цинка и серы записывает их молекулярные (атомные) веса).
Zn + S = ZnS.
65:32
2:1
При сокращении отношения, т. е. деления составляющих его чисел на 32, получают уже известное учащимся отношение 2:1.
Затем учитель делает расчет для другой реакции, причем выбирает пример с незнакомым учащимся весовым отношением реагирующих веществ (взаимодействие меди с кислородом, угля с кислородом). Показывает, как читать уравнения с произношением химических знаков, с произношением полных названий веществ и указанием числа молекул.
В последующих темах курса химии при записи химических уравнений необходимо следить за правильным пониманием смысла этих записей, требовать от учащихся чтения уравнения с указанием всех участвующих в реакциях веществ и количества их молекул. Кроме того, очень полезно возвращаться к словесному объяснению сущности химической реакции в свете атомно-молекулярной теории.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'