
5. Скорость химической реакции
Некоторые понятия о скорости химической реакции следует дать учащимся VII-VIII классов, учитывая необходимость подготовки их к дальнейшему обучению химии.
При систематическом развитии знаний о скорости химической реакции у учащихся должны возникнуть представления о том, что химическая реакция течет во времени и что химические реакции могут идти с разной скоростью, а затем на этой основе учитель может сформировать понятия о влиянии на скорость реакции как природы реагирующих веществ, так и различных условий.
Первое представление о том, что химическая реакция идет во времени, дают в самом начале курса химии, когда учитель приступает к формированию понятия о химическом явлении. Демонстрируя накаливание меди и магния на воздухе, нагревание сахара и др., он обращает внимание учащихся на то, что химическое взаимодействие требует определенного времени. Замечания о
скорости химических изменении делаются и при демонстрации других опытов. Например, учитель говорит: "Вы наблюдали, что при прилипании одного раствора к другому произошло изменение окраски. Вы заметили, что окраска растворов изменилась мгновенно. Это показывает, что и химическая реакция произошла очень быстро".
В теме VII класса "Первоначальные сведения о строении и составе веществ" учитель знакомит учащихся с условиями, влияющими на скорость реакции, и при знаками, по которым можно судить о скорости химического взаимодействия. Этими признаками могут быть 1) количество вещества, вступающего в реакцию за определенное время, 2) количество вещества, образующеюся при реакции за определенное время, 3) количество теплоты, выделяющейся за определенное время.
При изучении реакции разложения можно начать формирование понятия о том, что скорость химической реакции увеличивается с повышением температуры. Для "того проводят два параллельных опыта: в две одинаковые пробирки помещают равные количества основной углекислой меди, одну из пробирок нагревают слабее, а другую сильнее. Нагревание обеих пробирок прекращают в одно и то же время. Обсуждая с учащимися результаты опытов, обращается внимание на то, что в одной пробирке разложилось вещество и получилось продукта реакции больше, чем в другой. В той пробирке, где температура была выше, реакция шла быстрее, а в той, где ниже, - медленнее.
Рассматривая вопрос о получении кислорода в лаборатории, учитель говорит, что его можно получить при разложении не только марганцовокислого калия, но и бертолетовой соли.
Реакцию разложения бертолетовой соли изучают так. Б одну пробирку помещают чистую бертолетову соль, в другую - бертолетову соль с примесью двуокиси марганца. Обе пробирки закрывают пробками с газоотводными трубками и нагревают. Газы, выходящие из про-бирок, собирают над водой.
После этого учитель спрашивает, почему во втором случае получилось больше кислорода. У учащихся возникают предположения: 1) кислород во втором случае получался не только из бертолетовой соли, но и из двуокиси марганца, 2) бертолетова соль в присутствии двуокиси марганца быстрее разлагалась. Первое из этих предположений отвергают после того, как учитель показывает, что двуокись марганца при нагревании не выделяет кислорода. Для этого двуокись марганца нагревают некоторое время в пробирке, куда потом вносят тлеющую лучинку.
Чтобы дать понятие о катализаторе, нужно еще до-казать, что вся двуокись марганца, примешанная к бертолетовой соли, осталась химически не измененной. Для этого к содержимому пробирки, где шло нагревание смеси, приливают воды; после растворения хлористого калия жидкость фильтруют, осадок промывают водой и высушивают. На следующем уроке остаток, полученный после сжигания и прокаливания фильтра с осадкам, взвешивают. Полученную двуокись марганца снова примешивают к бертолетовой соли. Разложение идет быстрее.
Учитель говорит, что, хотя двуокись марганца в результате реакции химически не изменилась, она принимала участие в реакции. Об этом свидетельствует физическое изменение двуокиси марганца, которое происходит во время опыта и может быть замечено, если двуокись марганца взять в виде крупинок. После реакции она оказывается в виде мелкого порошка.
Теперь можно дать определение понятия катализатора: "Катализатором называется вещество, которое изменяет скорость реакции, но по окончании реакции остается химически не измененным". Выражение "изменяет скорость" удачно, так как позволяет в дальнейшем относить это определение не только к положительным катализаторам, увеличивающим скорость реакции, но и к отрицательным, уменьшающим ее.
Чтобы начать ознакомление учащихся с ускорением химической реакции при увеличении концентрации реагирующих веществ, после изучения состава воздуха учитель демонстрирует два параллельных химических опыта: сжигание одного и того же вещества (серы, фосфора) в кислороде и в воздухе. Эти опыты следует проводить с одинаковыми количествами вещества в одинаковых по форме и объему сосудах. Обращается внимание учащихся на разную яркость свечения, например, сера горит на воздухе еле заметным синеватым пламенем, а в кислороде более ярко. При разборе объяснений нужно, чтобы учащиеся осознали, что при горении серы в кислороде за одно и то же время выделяется больше теплоты, чем при горении того же количества серы на воздухе. После этого отмечают, что скорость химического взаимодействия веществ в первом случае больше, чем во втором, а затем уже переходят к выяснению причины ускорения реакции при горении серы в кислороде.
В беседе выясняют, что, хотя молекулы кислорода при своем хаотическом движении и в том, и в другом опыте могли встречаться и взаимодействовать с молекулами серы, число этих встреч в единицу времени было разным, так как во взятом объеме чистого кислорода молекул кислорода больше, чем в таком же объеме воздуха. Делают вывод: "Скорость химической реакции зависит от того, сколько молекул веществ реагирует в единицу времени. Чем больше молекул вступает в реакцию в единицу времени, тем скорость химической реакции больше".
При ознакомлении с химическими свойствами водорода учитель обращает внимание учащихся на то, что чистый водород, если его поджечь при выходе из стеклянной трубки, горит небольшим пламенем, так как взаимодействие водорода и кислорода, находящегося в воздухе, происходит лишь у отверстия трубки.
"Что же будет,- спрашивает учитель,- если водород и воздух предварительно смешать, а смесь нагреть до температуры воспламенения водорода?" Выясняется, что молекулы водорода и молекулы кислорода будут встречаться не постепенно, как при горении водорода, выходящего из трубки, а почти одновременно. Число молекул водорода и кислорода, реагирующих в единицу времени, будет больше, а следовательно, и скорость химической реакции резко увеличится. В этом случае выделится больше теплоты, что вызовет сильное нагревание и внезапное расширение образующихся водяных паров, произойдет взрыв.
Выдвинутое предположение проверяют на опыте, взорвав смесь водорода с воздухом в толстостенной банке, завернутой в полотенце.
В первой теме VIII класса внимание учащихся следует обратить на скорость: реакций нейтрализации, взаимодействия кислот с окислами металлов и с металлами. О скорости перечисленных реакций можно судить по скорости изменения окраски индикатора, растворения взятого окисла и по тому, как быстро идет выделение водорода. Эти сведения позволяют судить о том, что скорость химической реакции зависит не только от условии, но и от природы реагирующих веществ.
Используя уже приобретенные учащимися знания о растворении и растворах, следует объяснить разную скорость реакций тем, что реакция нейтрализации идет между растворенными веществами, а в реакциях между кислотами и металлами или окислами металлов участвуют твердые вещества, что ограничивает возможности взаимодействия молекул.
При дальнейшем изучении реакций обмена (между двумя солями, солью и кислотой, солью и щелочью) учитель отмечает, что эти реакции между растворенными в воде неорганическими веществами, подобно реакции нейтрализации при соприкосновении и перемешивании растворов, происходят почти мгновенно.
Закрепление знаний о скорости химической реакции полезно проводить с помощью экспериментальных задач. Например, учитель демонстрирует стакан, куда помещен сравнительно большой кусок мрамора, налит разбавленный раствор соляной кислоты, и предлагает указать, какие способы можно применить для ускорения реакции. Названные предположения проверяют на опытах с выданными дополнительно кусочками мрамора (измельчение, подогревание жидкости, добавление кон-центрированного раствора соляной кислоты).
Большое значение для развития знаний о скорости химической реакции может иметь тема "Металлы", где учащихся следует познакомить с ингибиторами. В самостоятельную работу по этой теме можно включить задания:
- Испытать отношение металлов (алюминия, цинка, железа, свинца, меди) к соляной кислоте. Отметить, какие из этих металлов реагируют с соляной кислотой; записать уравнения проведенных химических реакций.
- Отметить, какие из металлов реагировали с соля-ной кислотой активнее, т. е. в каких случаях реакция замещения водорода металлом идет с большей скоростью.
- Сделать общий вывод о взаимодействии металлов с соляной кислотой.
- Испытать отношение одного металла (цинка) к соляной и уксусной кислотам одинаковых концентраций. Отметить, в каком случае реакция замещения идет быстрее, и дать этому объяснение.
- В две пробирки налить одинаковые" количества соляной или серной кислоты (1:1) и опустить в них железные стружки. Когда начнется выделение водорода, в одну из пробирок добавить несколько капель формалина (40-процентный раствор), а другую оставить для сравнения. Наблюдать, как изменяется скорость реакции в той пробирке, куда, был прилит формалин.
- В пробирку с кислотой и железными стружками, которая в предыдущем опыте использовалась для сравнения, прибавить порошок, полученный из пол таблетки уротропина. Наблюдать, как будет идти в этой пробирке взаимодействие кисло и железа.
На основании опытов отмечают" что скорость реакций взаимодействия металлов с кислотами зависит от того, какие металлы и какие кислоты берут для этих реакций, а также от присутствия веществ-ингибиторов. Ингибитор замедляет скорость химической реакции, это - отрицательный катализатор.
В дополнение к самостоятельной работе учитель демонстрирует параллельные опыты, показывающие, что скорость взаимодействия металлов с кислотами зависит от концентрации кислоты, степени измельчения металла, а также от присутствия других веществ. Для проведения опытов следует, воспользоваться прибором, предложенным Г. Б. Вольеровым* и усовершенствованным учителем 569-й школы Москвы Г. Е. Васиком (рис. 1).
* ( Г. Б. Вольеров. Прибор для опытов, показывающих зависимость скорости химических реакций от различных факторов* "Химия в школе", 1962, № 3.)
- В сосуд помещают одинаковые количества гранул цинка (3-4) и приливают соляную кислоту: в один сосуд - 15-процентную, в другой - 5-процентную.
- Отвешивают равные количества гранулированного цинка разного размера (например, три крупные гранулы и десять мелких). Цинк помещают в сосуды, к нему приливают 5-10-процентного раствора соляной кислоты.
- В сосуды помещают по 3 гранулы цинка, приливают 5-10-процентного раствора кислоты. К одному из растворов предварительно добавляют 1 мл формалина.
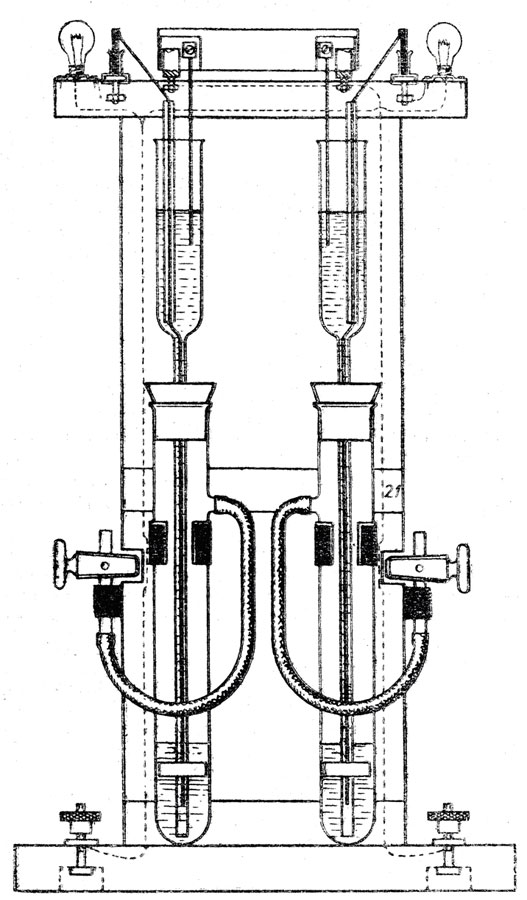
Рис. 1. Прибор для опытов по установлению зависимости скоростей химических реакций от различных факторов
При обсуждении опытов следует отметить не только зависимость скорости реакции от концентрации кислоты, степени измельчения металла (поверхности его со* прикосновения с кислотой), но и обратить внимание учащихся на то, какое влияние на взаимодействие цинка с соляной кислотой оказывает формалин. Если по отношению к реакции железа, с соляной кислотой он являлся ингибитором, то в этом случае он играет роль катали-затора.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'