
Реакция обмена
Сущность реакции обмена выясняется после изучения теории электролитической диссоциации. Учащиеся проводят лабораторные опыты, записывают в молекулярном виде уравнения реакций обмена, а затем выясняют, в чем заключаются те основные процессы, которые приводят в каждом случае к образованию нового вещества.
Сначала рассматривают реакцию обмена с образованием осадка, например реакцию, происходящую при переливании раствора сернокислого натрия к раствору хлористого бария. Затем разбирают примеры реакций с выделением летучего вещества и с образованием слабого электролита (здесь обязательно рассматривают реакцию нейтрализации, а если есть время, и другую реакцию ,с образованием слабодиссоциирующего вещества).
Далее необходимо подвести некоторые итоги и от-метить, что к двум известным учащимся еще в VIII классе условиям течения реакции обмена до конца (выпадение осадка, выделение газообразного продукта) присоединилось еще одно-образование слабодиссоциирующего вещества. На основе полученных знаний полезно вывести общее правило о направлении течения реакций обмена: "Реакция обмена в растворе электролитов идет в ту сторону, где имеется меньшее количество свободных ионов".
В самостоятельные работы следует включить несколько типов задач:
1. Между какими из следующих попарно взятых веществ будут происходить реакции обмена: a) KCl и AgNO3, б) СаСO3 и NaCl, в) H2S и Na2SO4, г) KNO3, Н2O л) NaCl и H2SO4, е) Са(ОН)2 и HNO3? Дайте объяснения.
2. Как осуществить превращения: а) Сu2+ + ОН- → Сu(ОН)2, б) Ag+ + Cl- → AgCl, в) Ba2+ + SO42- → BaSO4, г)H+ + S2- → H2S, д) H+ + CO32- → Н3СO3, е) Н+ + ОН- → Н2O?
Для каждого случая дайте два решения и напишите соответствующие уравнения реакций.
3. При сливании каких растворов можно получить следующие вещества: а) гидрат окиси железа, б) серно- кислый барий, в)фосфорнокислый кальций, г) углекислый кальций, д) гидроокись алюминия?
4. Как можно осуществить следующие превращения: a) Na2SO4 NaCl; б) NaCl → ↓NaNO3, в) К2СO3 → КСl?
5. Как можно осуществить следующие превращения: г) СаСО3 → СаСl2, б) FeS → FeCl2, в) СН3СООН → CH3COONa?
Чтобы развить у учащихся умение применять теорию этектролитической диссоциации к решению тех или иных вопросов химии, необходимо научить их "мыслить ионами". Это осуществляется в результате постоянного использования ионной теории при разборе фактического материала и решения задач. Только при этом учащиеся убеждаются, что ионная теория облегчает рассуждения, помогает быстро подбирать вещества, необходимые для получения требуемого продукта.
Для решения задач первого типа следует сначала записать уравнение предполагаемой реакции в молекулярном виде:
KCl + AgNO3 = KNO3 + AgCl↓
Выясняют, что в этом случае оба исходных вещества растворимы в воде и являются сильными электролитами, а один из продуктов реакции, хлористое серебро, нерастворим в воле. Поэтому химическое взаимодействие при сливании растворов взятых веществ возможно: оно приводит к уменьшению в растворе количества свободных ионов. Сущность реакции обмена выражают ионным уравнением:
Ag+ + Cl- = AgCl↓
Чтобы решить задачу второго типа, нужно найти вещества, растворимые и сильно-диссоциирующие в воде, дающие необходимые ионы. Получение учащимися нескольких решений каждой задачи позволяет учителю обратить их внимание на то, что выяснение сущности реакций обмена помогает выделить целые группы весьма сходных между собой химических превращений.
Задачи третьего типа несколько сложнее предыдущих. Здесь не указаны ионы, которые дают при соединении то или иное из требуемых веществ. Эти ионы приходится сначала наметить и тем самым свести задачу третьего типа к задаче второго типа.
В задачах четвертого типа нужно превратить одну растворимую соль в другую растворимую соль того же металла. Разбирают решение задачи, предлагающее осуществить превращение Na2SO4 → NaCl, которое сводится к такому изменению 2Na- + SO4" → Na + Cl'. Следовательно, исходную соль Na2SO4 нужно растворить в воде, из раствора удалить-ионы S04" и ввести в него ионы Сl'. Кристаллы поваренной соли получают выпариванием раствора.
Ионы SO4" связываются ионами Ва; которые имеются как в растворах солей бария, так и гидроокиси бария. Но так как в раствор нужно ввести ионы хлора, для данной реакции можно взять только хлористый барий:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Задачи пятого типа заключаются в превращении не-растворимого или слабо-диссоциированного вещества в вещество растворимое и диссоциированное.
Чтобы из углекислого кальция получить хлористый кальций, нужно из раствора удалить ионы СO3" и ввести ионы Сl'. Какие же ионы могут еще прочнее, чем ионы Са", связать находящиеся в растворе ионы СО3"? Вспоминают, что ионы СO3" дают с ионами Н' мало-диссоциированное и очень непрочное соединение - угольную кислоту, которая Р момент своего образования разлагается на воду и двуокись углерода, удаляющуюся из раствора в виде газа. Поэтому для превращения СаСO3 → СаСl2 нужно взять кислоту, и притом соляную, так как только она даст ионы хлора.
При изучении органической химии получает дальней-шее развитие понятие о радикальном механизме химических реакций. Рассматривая, как происходит взаимодействие этана с хлором, учитель отмечает, что молекулы хлора под действием света расщепляются на атомы, имеющие неспаренные электроны. Затем осуществляется цепь следующих превращении:
Сl× + С2Н6 → С2Н5× + НСl,
С2Н5× + Сl2 → С2Н5Сl + Сl×
и т. д.
Частицы, имеющие неспаренный электрон (Сl×,С2Н5×), называются свободными радикалами.
Углубление знаний о цепном механизме ряда химических реакций следует провести при изучении полимеризации хлористого винила в присутствии перекиси бензоила. Перекись бензоила разлагается в условиях реакции полимеризации с образованием свободных радикалов (здесь учащимся снова напоминают, что называют свободным радикалом):
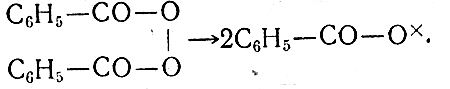
Радикал С6Н5- СO- O× обозначаем для удобства записи одной буквой R× с крестиком, изображающим неспаренный электрон. Тогда механизм реакции полимеризации хлористого винила можно выразить записью:
R× + CH2 = CHCl → R - CH2 - CHCl×,
R - CH2 - CHCl×4 CH2 = CHCl → R - CH2 - СНСl - СН2-СНСl×
и т. д.
В заключение разбора отметить, что основное отличие цепной полимеризации от цепных реакций низкомолекулярных соединений в том, что все молекулы, участвующие в развитии одной цепи химических превращений, оказываются соединенными посредством химических связей в одну макромолекулу.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'