
Отделение больших количеств самария от микроколичеств соседних редкоземельных элементов (А.К. Лаврухина, Г.М. Колесов)
Задача отделения больших количеств одних элементов от других, присутствующих в микроконцентрациях, довольно часто встречается в радиохимическом анализе продуктов ядерных реакций, когда отношение концентраций облученного вещества и образующихся радиоактивных изотопов очень велико и составляет 1012-1015.
Для группового отделения элементов и концентрирования примесей наиболее перспективен метод электролиза с ртутным катодом. Благодаря высокому перенапряжению водорода на ртути можно электролитически выделять многие элементы, не выделяющиеся ни на каком другом катоде.
По методу Мак-Коя [1] электролизом ацетатно-цитратных растворов ъ присутствии ионов калия удавалось выделять в виде амальгам только Eu, Yb и Sm, т. е. рзэ, проявляющие устойчивое двухвалентное состояние.
Исследования влияния катодной плотности тока, продолжительности электролиза, лрироды и концентрации щелочных металлов и комплексообразующих лигандов, температуры и кислотности электролита позволили определить оптимальные условия для выделения этих элементов [2-10] и обнаружить, что ультрамалые количества остальных рзэ также могут быть выделены на ртутном катоде [7, 9, 11 -13].
На основании экспериментальных данных высказываются две точки зрения о механизме процесса выделения рзэ на ртутном катоде: восстановление до двухвалентного состояния с последующим образованием амальгамы [10, 11] и выделение за счет образования гидридов [14, 15].
В данной работе приведены некоторые результаты опытов по нахождению условий быстрого отделения больших количеств самария от ультрамикроколичеств соседних рзэ.
Методика проведения электролиза аналогична ранее описанной [7]. Для удобства работы несколько видоизменен электролизер (рис. 1). Ячейка 7, окруженная рубашкой для охлаждения 2, снабжена снизу двухходовым краном и соединена С уравнительной склянкой со ртутью 3. Исходный раствор (4) с определенной концентрацией Sm3+, К+, СН3СОО- и Cit3- (pH 5,8-6,0) вводили в ячейку по трубке 5. В качестве анода использовали платиновую спираль 6. Ртуть и раствор перемешивали мешалкой 7, приводимой в движение мотором 8 со скоростью 200 об/мин. Температуру в интервале от 0 до 3°С поддерживали смесью сухого льда и воды 9. Источник тока - селеновый выпрямитель ВСА-10; напряжение в процессе опыта изменялось от 8 до 12 в, начальная плотность тока равнялась 100 ма/см2. Потенциалы катода измеряли компенсационным методом при помощи прибора ЛП-5 с дополнительно включенным элементом Вестона. Для исследования использовали ∼ 99,5%-ную Sm2O3 (примеси - 0,5% Eu203 и ~ 0,01 % Gd2O3) и радиохимически чисты изотопы Sm153, Pm147 и Се144. В процессе электролиза ртуть сменяли каждые 30 мин., амальгаму Sm и К разлагали AN НС1 и определяли Sm весовым методом, а также радиометрически по Sm153. Поведение Pm147 и Се144 контролировали по их активности. Ошибка измерений не превышала ± 5%.
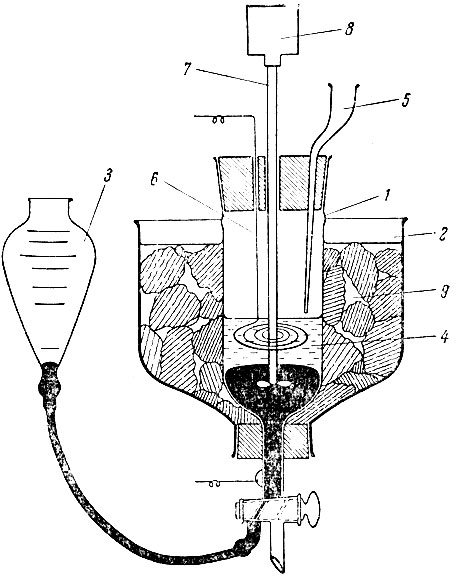
Рис. 1. Прибор для электролиза с ртутным катодом. сухого льда и воды. 1 - ячейка; 2 - рубашка для охлаждения; 3 - уравнительная склянка со ртутью; 4 - исходный раствор; 5 - трубка для введения раствора; 6 - анод; 7 - мешалка; 8 - мотор; 9 - смесь
Как видно из рис. 2, степень перехода Sm практически не изменяется в области концентраций от 1 × 10-6 до 6 × 10-2 М, несмотря на то, что молярное отношение Sm3+: Cit3- увеличилось в 10 000 раз. При повышении содержания самария от 1,2 × 10-1 до 5,8 × 10-1 М степень его выделения резко снижается (с 94 до 24%), хотя отношение Sm3+ : Cit3- сохранялось постоянным и равным 1 : 2. Это подтверждается и рис. 3, из которого следует, что при изменении концентрации Sm от 5,8 × 10-2 М (кривая 1) до 5,8 × 10-1 М (кривая 3) даже после 10-кратной смены ртути удается выделить только 77,3% Sm. Наблюдаемое уменьшение степени выделения самария обусловлено достижением насыщения ртути при содержании в ней 0,05% Sm. Поэтому, сохраняя ранее найденные оптимальные условия электролитического выделения самария, увеличивают поверхность ртутного катода и количество ртути до 900 г. Полученные данные приведены в таблице и на рис. 3. Кривые 2 и 3 рис. 3 и данные таблицы показывают, что при увеличении поверхности катода от 10,6 до 28 см2 резко возрастает выход Sm (до 99,6%) и вдвое сокращается продолжительность электролиза. В электролитическом ячейке с поверхностью катода 44 см2 уже в течение часа при двукратной смене ртути и катодной плотности тока 100 ма/см2 выделяется свыше 99% Sm.

Отделение Sm от Pm электролизом на ртутном катоде Поверхность катода 28,2 см2; плотность тока 100 ма/см2; объем раствора 20 мл; pH 5,8-6,0. Введено 1000 мг Sm2O3,
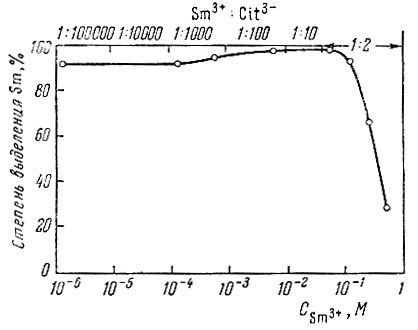
Рис. 2. Зависимость выделения Sm на ртутном катоде от его концентрации и молярного соотношения Sm3+ : Cit3-
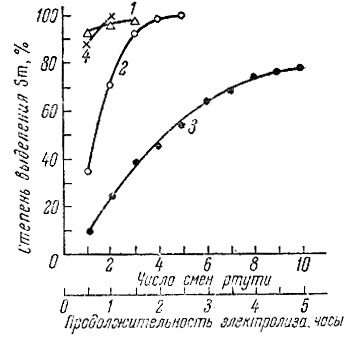
Рис. 3. Зависимость выделения Sm от числа смен ртути (продолжительности электролиза). Кривые 1 и 3 получены при площади катода 10,6 см2 (200 г Hg); 2 и 4 - соответственно при 28,2 и 44 см2 (400 и 900 г Hg). Плотность тока 100 ма/см2. Исходные количества Sm2O3: 100 мг (кривая 1) и 1000 мг (кривые 2-4)
Предварительные данные об отделении 2000 мг Sm203 показывают, что двукратной сменой ртути удается отделить 82,3% Sm, а четырехкратной (в течение двух часов электролиза) - 99,4%.
В предыдущих сообщениях [7, 8, 11] было показано, что при условиях, благоприятных для количественного выделения 100 мг Sm, в ртутный катод переходят также и радиоактивные изотопы Pm и Се. Так, из кривых 1 и 2 рис. 4 следует, что при проведении электролиза в течение 1,5 час. при плотности тока выше 50 ма/см2, когда в растворе остается еще 3-5% Sm, выделяется около 50% Pm. При более высоких плотностях тока Pm не выделяется лишь в первые 30 мин. [8]. Переход Pm и Се в ртуть, как показали исследования [7, 8], происходит только после образования смешанной амальгамы Sm и К или Li, имеющей более высокий отрицательный потенциал, и зависит от концентрации цитрата калия.
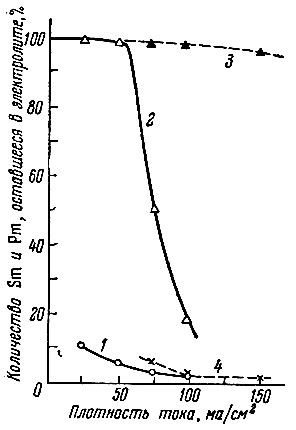
Рис. 4. Зависимость оставшегося в электролите количества Sm (кривые 1,4) и Pm (кривые 2, 3) от плотности тока при продолжительности опыта 1,5 часа. Кривые 3 и 4 получены при добавлении цитрата калия в процессе электролиза
Эти наблюдения позволили высказать предположение о том, что переход ультрамалых количеств Pm и Се в ртутный катод можно предотвратить, если в процессе электролиза проводить периодическую смену ртути или добавление цитрата калия и тем самым создавать условия,- аналогичные начальному моменту электролиза. Опыты подтвердили это предположение. При таких условиях Рис. 4. Зависимость оставшегося проведения электролиза Pm, а также и Се практически полностью остаются в лектролите (см. таблицу, кривую 3 рис. 4); выход Sm в амальгаму не изменяется (кривая 4 рис. 4).
В связи с тем, что поведение других элементов цериевой группы в процессе электролиза с ртутным катодом должно быть аналогично поведению Pm и Се, определенные нами условия выделения Sm могут быть использованы для количественного отделения его больших количеств от микропримесей более легких рзэ.
Литература
- Н. N. McCoy. J. Am. Chem. Soc., (58, 1579 (1963); 63, 3432 (1941); Inorganic Synteses, v. 2. N. Y.-L., 1946, p. 65.
- Д. И. Рябчиков, Ю. С. Скляренко, H. С. Строганова. ЖНХ, 1, 1954 (1956); 4, 1958, 2682 (1959).
- Е. I. Onstott. J. Am. Chem. Soc., 77, 2179 (1955); 78, 2070 (1960).
- И. С. Скляренко, И. Э. Краузе, В. А. Морозова. Сборник научных трудов Гиредмета, т. 1. М., 1959, стр. 110.
- D. Nauman, W. Неуnе. J. Prakt. Chem., 8, 28 (1959).
- А. К. Лаврухина, Г. М. Колесов. Материалы Второго совещания по нейтронодефицитньгм изотопам редких земель, т. 3. Дубна, изд. ОИЯИ, 1909, стр. 75.
- А. К. Лаврухина, Г. М. Колесов, Тан Сяо-ен. Радиохимия, 3, 724 (1961).
- А. К. Лаврухина, Г. М. Колесов, Сан Суо-ен. ДАН СССР, 134, 1406 (1960).
- А. К. Лаврухина, Г. М. Колесов, Тан Сяо-ен. Материалы Третьего совещания по нейтронодефицитным изотопам, т. 3. Дубна, изд. ОИЯИ, 1960, стр. 133.
- В. П. Шведов, Фу И-бей. Радиохимия, 2, 57 (1960).
- А. К. Лаврухина, Г. М. Колесов, Тан Сяо-ен. Доклад на Международной конференции по применению изотопов в физических науках и промышленности. Копенгаген, сентябрь, 1960.
- В. П. Шведов, Фу И-бей. Радиохимия, 2, 231, 234 (1960).
- Фу И-бей. Автореферат диссертации. Л., Гос. ун-т, 1960.
- Е. I. Onstott. J. Am. Chem. Soc., 81, 4451 (1959).
- L. Treindl. Collect. Czechosl. Chem. Comm., 24, 3389 (1959).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'