
Джон Дальтон
Работы Дальтона имели исключительно важное значение для развития химических знаний. Дальтону удалось объединить лучшие черты атомистических представлений Юнгиуса, Бойля, Ньютона и Ломоносова с новыми химическими воззрениями (и в первую очередь с более точным определением понятия элемента у Лавуазье). Так возникла новая атомистическая теория, на основе которой были впоследствии математически описаны химические превращения.
Джон Дальтон родился 6 сентября 1766 г. в английской деревушке Иглсфилд в бедной семье. Он проложил себе путь в науку благодаря постоянному самообразованию, упорным систематическим занятиям естественными науками. Уже в возрасте двенадцати лет Дальтон стал преподавателем в школе своей деревни, а три года спустя он начал работать учителем в небольшом городке Кендале, расположенном неподалеку. С 1787 г. Дальтон, продолжая преподавательскую деятельность, стал писать научные и научно-популярные работы по математике, оптике, астрономии и географии. В 1793 г. он был приглашен преподавателем математики и естественных наук в Манчестер. С тех пор Манчестер стал постоянным местом жительства Дальтона, хотя научные доклады, особенно по химии, он читал и в Лондоне, и в Бирмингеме, и в Глазго. В 1822 г. Дальтон был избран членом Лондонского Королевского общества; позже он был избран членом ряда иностранных научных обществ, в том числе членом-корреспондентом Парижской Академии наук (1806 г.). Умер Дальтон 27 июля 1844 г. в Манчестере.

Джон Дальтон (1766-1844)
Исследования Дальтона проводились в период промышленной революции в Англии. Процесс капиталистической индустриализации здесь начался в первую очередь с развития легкой промышленности, особенно текстильной. В связи с потребностями текстильного производства в Англии стало развиваться производство серной кислоты, соды по методу Леблана, хлорной извести. Работы Дальтона и других английских химиков в то время были связаны с научным обоснованием увеличения производства химических товаров, что в свою очередь способствовало развитию химии как науки.
Вначале Дальтон изучил тесно связанную с метеорологическими вопросами проблему природы (состава и свойств) земной атмосферы. Он хотел понять, почему газы атмосферы составляют смесь с определенными физическими свойствами, а не располагаются друг под другом в соответствии с их различными плотностями. Решение этой проблемы имело большое практическое значение, поскольку знание точного количественного состава воздуха было очень важным для химиков, технологов, промышленников. Эти знания широко применялись при усовершенствовании металлургических процессов, а также в технологии получения газа для освещения городов. Уже в 1813 г. газ, образовавшийся при коксовании каменного угля в печах, был впервые применен в Лондоне Для освещения улиц.
Дальтон развил в своих исследованиях представления Ньютона, изложенные в его работе "Математические начала натуральной философии", опубликованной з 1687 г. Ньютон показал, что газ состоит из мельчайших материальных частичек, силы отталкивания между которыми растут пропорционально уменьшению расстояния между ними. Дальтон считал, что отталкивание происходит только между частицами определенного вида газа, в то время как частицы других газов не должны отталкиваться.
Дальтон показал, что эти мельчайшие частицы растворяются не только в фазе, где сосуществуют два газа, но и в системе, образованной газом и жидкостью. Растворимость различных газов в воде он объяснил таким образом: "Эта разница тесно связана с тяжестью, весом и числом мельчайших частиц в различных газах. Подвижность более легких и меньших по размерам частиц падает. Рассмотрение роли относительной тяжести мельчайших частичек тел, насколько я знаю, является совершенно новым предметом исследования. Я начал недавно эти работы и достиг некоторых успехов" [25, с. 12-131.].
Результаты своих определений относительных весов мельчайших частиц Дальтон обобщил в 1803 г. в таблице, озаглавленной "Соотношения весов мельчайших частиц газообразных и других тел". Приняв за единицу атомную массу водорода, Дальтон определил относительные атомные массы азота (4), углерода (4,5), кислорода (5,66), серы (17), воды (6,66) и других веществ8.
Эти атомистические представления Дальтон использовал для объяснения хода химических превращений. На основании открытого Прустом закона постоянного состава соединений Дальтон установил, что в различных соединениях двух элементов, таких, как, например, оксид меди(I) и оксид меди (II) или метан и этан, составляющие их элементы находятся в определенных отношениях. Так он открыл закон кратных отношений9. Закон простых кратных отношений был открыт Дальтоном, когда он на основании атомистической теории рассматривал химические реакции как тесно связанные друг с другом процессы соединения и разделения атомов взаимодействующих веществ. Только на основании этих представлений можно объяснить, почему процессы превращения одного соединения в другое зависят лишь от скачкообразных изменений состава веществ. Поэтому каждый атом какого-либо элемента должен кроме определенной массы обладать также специфическими свойствами и быть неделимым.
Дальтон так описывал свой путь к этому представлению: "Хотя мельчайшие частицы такого вещества, как вода, равны, поскольку они обладают одинаковой формой,, одинаковым весом и т. д., существует еще один важный вопрос. Из того, что нам известно, мы не можем предположить, в чем заключается различие этих частиц: если они присутствуют в воде, находятся ли они в элементах, из которых состоит вода, т. е. в водороде и кислороде? Неизвестно, если некоторые частицы воды легче, чем другие, будет ли часть жидкости при определенных условиях образовываться из таких легчайших частиц и как все это должно влиять на удельный вес воды. Аналогичные замечания можно сделать и по отношению к любому другому веществу; мы должны исходить из предположения, что мельчайшие частицы всех гомогенных веществ должны быть полностью идентичны по весу, форме и другим свойствам. Иными словами, каждый атом воды должен быть идентичен любому другому атому воды; каждый атом водорода не должен отличаться по всем свойствам от любого другого атома водорода и т. д." [26, с. 15]. При этом Дальтон не делал принципиального различия между мельчайшими частицами соединений и элементов, т. е. между молекулами и атомами. Молекулы (называл "сложными атомами".
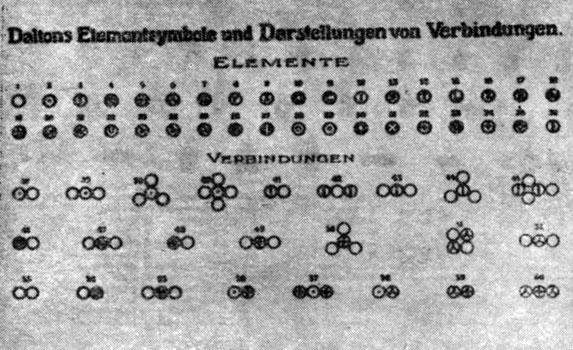
Примеры химических знаков, предложенных Д. Дальтоном
Образно обрисовывая предмет химии, Дальтон писал: "Химический анализ и синтез идут не далее, чем до отделения частиц друг от друга и их воссоединения. Никакое новое создание или разрушение материи не может быть достигнуто химическим действием... Единственные изменения, которые мы можем произвести, состоят в отделении друг от друга частиц, находящихся в состоянии сцепления или соединения, и в присоединении друг к другу частиц, находящихся на расстоянии" [26, с. 91].
Хотя сделанные Дальтоном определения атомных весов были недостаточно точными, разработанная английским ученым атомистическая теория внесла в химию первые ясные представления о строении элементов и их соединений и позволила количественно объяснить и предвидеть химические явления. Большинство химиков тотчас восприняли основные положения теории Дальтона и стали развивать их.
Особенно большое значение имели работы шведского химика Й. Я. Берцелиуса, который дал более точные определения атомных масс.
Уже до Берцелиуса Дальтон пользовался атомной теорией как основой для новой химической символики. Дальтон отбросил применявшиеся в то время химические знаки, которые не отражали количественного состава соединений, и предложил для каждого элемента символ, обозначающий его атом. Состав соединения он изображал соположением символов атомов, из которых оно состоит10.

Примеры химических знаков, предложенных Д. Дальтоном
Однако формулы, предложенные Дальтоном, не всегда давали представление об истинном числе атомов, образующих соединения: количественный элементарный анализ позволял ученому лишь судить об относительных массах элементов, входящих в состав соединения. Для изображения формул соединений Дальтон ввел "принцип наибольшей простоты". Он произвольно предположил, что, если два элемента образуют только одно соединение, оно должно содержать по одному атому каждого из них. Так, например, наименьшая частица воды в соответствии с представлениями Дальтона состоит из одного атома водорода и одного атома кислорода.
Работы Дальтона имели основополагающее значение для дальнейшего развития химии. Берцелиус с полным правом назвал их важнейшей вехой в становлении химической науки. Атомистическая теория Дальтона отчетливо показала важность теоретических построений для развития экспериментальных химических исследований. Недаром Фридрих Энгельс назвал Дальтона "отцом современной химии" [23, с. 608]. Атомистическая теория Дальтона оказала очень сильное влияние на развитие теоретической химии и создание рациональной технологии возникающей крупной химической промышленности в XIX в. Трудами Дальтона старое материалистическое учение - атомистика - получило новое естественнонаучное обоснование. Гем самым был сделан существеннейший вклад в разработку материалистического мышления естествоиспытателей XIX в. Атомистическая теория Дальтона способствовала также становлению диалектико-материалистического мировоззрения. Фридрих Энгельс в своей книге "Диалектика природы", неоднократно ссылаясь на работы Дальтона, доказывал, что диалектический закон перехода количественных изменений в качественные в химии конкретизируется в законах постоянных и кратных отношений, которые тем самым обосновываются в свою очередь с общих естественнонаучных позиций11,12.
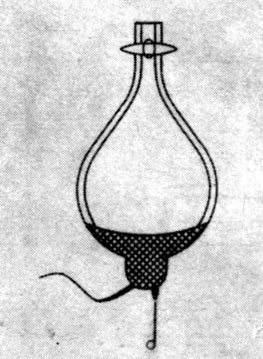
Эвдиометр, который использовал Дальтон при исследованиях газообразных углеводородов
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'