
Вальтер Коссель. Гильберт Ньютон Льюис
Выдающиеся открытия в естествознании, которые в течение последних пятидесяти лет не раз приводили к коренной ломке сложившихся представлений, не только показали ограниченность научных взглядов классиков естествознания. Они привели к новым философским выводам и дали доказательство тому, что "природа есть пробный камень диалектики". Как и ранее, новые открытия могли быть правильно оценены и использованы лишь благодаря осмысливанию рационального зерна классической немецкой философии и ее дальнейшего развития. Для современного естествознания также характерно новое истолкование сделанных ранее открытий, что стало возможно в результате расширения научного кругозора.

Вальтер Коссель (1888-1956)
Электрохимическая теория Берцелиуса и вытекающие из нее дуалистические представления были оставлены химиками после неудачной попытки распространить их на органические соединения. Затем спустя сто лет представление об электрических зарядах как о "кирпичиках" атомов, следующее из атомной модели Резерфорда - Бора, вошло как прочная составная часть в теоретическую химию. Так подтвердилось предсказание А. Кекуле, сделанное им в 1877 г.: "Столь остроумно разработанная великим Берцелиусом электрохимическая теория... оказалась недостаточной. По всей вероятности, при дальнейшем развитии науки к этой теории вновь будет привлечено внимание, и тогда она в обновленном виде снова принесет пользу" [1, с. 77].
Впервые представление о том, что электрические силы можно обнаружить у химических элементов и их соединений, было выдвинуто Й. Берцелиусом в его электрохимической теории в 1818 г. Однако после того, как в органической химии теории радикалов и типов оказались несостоятельными, ученые отказались и от электрохимических представлений. Лишь во второй половине XIX в., когда от радикалов перешли к истинным "кирпичикам" материи - атомам, вновь пробудился интерес к этим представлениям. Проведенное физиками в результате интенсивного исследования природы электрических разрядов и изучения электрического освещения открытие атомистической природы электричества сделало весьма актуальными идеи Й. Берцелиуса. Данные, полученные при исследовании природы вакуума, также нельзя было объяснить в рамках классической физики. Когда У. Крукс в 1876 г. на отрицательном полюсе находящейся под высоким вакуумом электрической разрядной трубки, катоде, обнаружил свечение, ученый считал его новой лучистой формой материи. Дж. Стони в 1891 г. назвал эти катодные лучи электронами. В 1895 г. Жан Перрен показал, что электроны отрицательно заряжены, а в 1897 г. Дж. Томсон определил их скорость. В результате дальнейших исследований Томсон пришел к выводу, что электроны образуют субстанцию электричества, что оно состоит из частичек, иными словами имеет атомарную природу. Эти выводы явились существенным шагом на пути к познанию строения атома.
В это же время атомистические представления получили окончательное признание и в химии. Теория электролитической диссоциации Аррениуса и измерения электропроводности, которые привели к изменению представлений о природе кислот, оснований и солей, позволили убедиться, что органические соединения и даже так называемые неэлектролиты могут образовывать ионы. Работы Беккереля, и также супругов Кюри дали последний толчок для создания новых представлений о строении химических элементов и их соединений.
Учение об электричестве и данные физико-химиков в конечном итоге привели к работам, первым разультатом которых была атомная модель Резерфорда - Бора.
Констатация В. Нернстом и Дж. Томсоном положения, что электростатические силы притяжения противоположно заряженных ионов электролиза зависят от диэлектрической постоянной растворителя, а также работы Ф. Ленарда по изучению катодных лучей позволили представить ионы, как особый вид "химического соединения" между атомом или радикалом и электроном.
На основании этих представлений, а также выводов, вытекающих из Периодической системы элементов, Р. Абегг пришел к заключениям, согласно которым химическое сродство атомов можно рассматривать как сродство атомов к электронам. Сродство к электрону, согласно Р. Абеггу, имеет полярную природу, и в соответствии с этим существуют два крайних типа соединений, гетерополярные и гомеополярные. К гетерополярным соединениям Абегг отнес соли-электролиты, а к гомеополярным - органические вещества. Основываясь на Периодической системе элементов, Абегг сформулировал фундаментальное правило: "Каждый элемент обладает как положительной, так и отрицательной максимальной валентностью, суммарное значение которых постоянно равно числу восемь" [1, с. 80]18. Тем самым он до некоторой степени предвосхитил более позднюю "октетную теорию".
Пристальное внимание исследователей в начале нашего столетия привлекло установление физического смысла химических сил. Большое значение для развития учения о валентности имели работы И. Штарка. На основании "новейших достижений квантовой теории Штарк предпринял разработку старой гипотезы Берцелиуса об электрической природе химических валентных сил" [1,с. 81]. Штарк предположил, что на внешней оболочке атома имеется небольшое число электронов, за счет которых в основном и происходит образование химической связи между двумя атомами. Эти "поверхностные" электроны, которым присуща особая химическая функция, Штарк назвал "валентными электронами". "Валентное число" химического элемента обозначает число валентных электронов, расположенных на внешней оболочке атома19.
Понятие "валентные электроны" было принято при построении атомной модели Резерфорда - Бора. Эта модель привела к различным способам объяснения валентных сил и образования химических связей между атомами.
Хотя представления Штарка не вызвали ожидаемого отклика, теорию химической связи оказалось возможным построить в первые десятилетия нашего века на основе атомной модели Резерфорда - Бора и данных атомной физики. В создание такой теории внесли вклад многие физики и химики. Но особенно следует подчеркнуть ту роль, которая принадлежит здесь Вальтеру Косселю и Гильберту Ньютону Льюису, с чьими именами тесно связана новая теория.
Вальтер Коссель родился 22 мая 1888 г. в Берлине20 в семье известного физиолога, лауреата Нобелевской премии по медицине и физиологии 1910 г. Альбрехта Косселя. Вальтер Коссель изучал физику у таких выдающихся ученых, как Ф. Ленард, В. Рентген, А. Зоммерфельд и М. Лауэ. В 1911 г. он защитил докторскую диссертацию под руководством Ленарда.
Научные интересы Ленарда определили область исследований, которыми впоследствии решил заниматься Коссель. Так, до 1921 г. Вальтер Коссель изучал преимущественно природу валентных сил и рентгеновские спектры. Новый взгляд на строение электронных оболочек атомов в связи с Периодической системой элементов побудил В. Косселя изучить в 1914-1920 гг. зависимость между рентгеновскими и видимыми спектрами. Результаты этих исследований Коссель опубликовал в книге "Валентные силы и рентгеновские спектры". Впоследствии Коссель изучал рентгеновское излучение и свойства кристаллов.
Вначале он был профессором физики в Кильском университете, затем в Высшей технической школе в Данциге (ныне Гданьск, ПНР) и, наконец,- в Тюбингенском университете.
Работы Косселя о гетерополярных связях имели решающее значение для понимания ионной связи и тем самым для разработки общей теории химической связи. В 1928 г. Коссель выдвинул теорию роста кристаллов. В этой теории ученый дал наглядную картину связей с различной энергией, которые должны образовать ,атом или ион, присоединяющийся к неодинаковым участкам поверхности кристалла. Под влиянием своего учителя Макса фон Лауэ Коссель предпринял исследования интерференции рентгеновских лучей. В 1934 г. он открыл явление, получившее название "коссель-эффект" - интерференцию рентгеновских лучей, когда их источник находится в самом кристалле.
На основании работ Резерфорда - Бора, особенно тех, где Резерфорд показывает существование электростатического взаимодействия в атоме, Коссель сделал следующий вывод: "У меня нет сомнений, что и междуатомный мир химической связи следует еще раз основательно проверить, действительно ли в нем есть нечто, кроме электростатики" [106, с. 127]. Опираясь на работы Бэрклы и Мозли по рентгеновским спектрам21, Коссель пришел к выводу, что электронные оболочки содержат определенное число электронов и что существует тенденция к их более полному заселению. В этой связи особое значение приобретали благородные газы. Согласно Косселю, они являются "образцом, подражание которому обусловливает сильную химическую активность соседних элементов" [106, с. 128].

Гильберт Ньютон Льюис (1875-1946)
Конфигурация орбит, аналогичная благородным газам, какого-либо элемента или соединения являлась, по мнению В. Косселя, также "желанным" состоянием стабильности, и, следовательно, реакционная способность атома определяется его стремлением приобрести такую конфигурацию.
В то время как Коссель исследовал преимущественно соединения с ионной связью, т. е. соединения, в которые входят элементы, различные по химической природе (как, например, в хлориде калия), американские ученые Г. Льюис и И. Ленгмюр обогатили эту теорию, изучая соединения с атомными связями.
Американский физикохимик Гильберт Ньютон Льюис22 родился 23 октября 1875 г. в городке Веймаус, расположенном близ Бостона. Он учился в штате Небраска, а высшее образование получил в известном Гарвардском университете и в 1899 г. защитил там докторскую диссертацию. После завершения химического образования в США Льюис отправился в 1900 г. в Германию, где работал в основных в то время центрах физической химии - в лабораториях Оствальда в Лейпциге и Нернста в Гёттингене. В Германии Льюис получил прекрасное физическое образование. После возвращения на родину Льюис сначала был профессором в Гарвардском университете, а затем профессором университета в Беркли в Калифорнии.
Скончался Льюис 23 марта 1946 г. в Беркли. Льюис был многосторонним ученым, обогатившим результатами своих работ как химию, так и физику. В Беркли он создал исследовательский центр по физике, получивший мировое признание.
![Ирвинг Ленгмюр (1881-1957); внес [значительный] вклад в изучение химической связи; лауреат Нобелевской премии по химии 1932 г. за работы по химии поверхностноактивных веществ](pic/000194.jpg)
Ирвинг Ленгмюр (1881-1957); внес [значительный] вклад в изучение химической связи; лауреат Нобелевской премии по химии 1932 г. за работы по химии поверхностноактивных веществ
Наиболее важным научным достижением Льюиса является обнаружение причины образования неполярных или слабополярных химических связей. Как и Коссель, который исследовал связи в гетерополярных соединениях, Льюис также исходил из структуры благородного газа. Косселю для гомеополярных соединений не удалось найти электростатического объяснения их природы, исходя из атомной модели Резерфорда - Бора. Согласно же Льюису, например, в молекуле водорода или хлора тип благородного газа достигается за счет компенсации спинов обоих одиночных электронов в электронную пару23 - дублет связывающих электронов. Льюис предполагал, что в неполярных и слабополярных соединениях наиболее устойчивы группы из восьми электронов, так называемых восьмиэлектронных оболочек. Ленгмюр назвал такую группу "октетом" и предложил способ записи этих связей, в котором каждый валентный электрон изображается точкой24.
Данный Ленгмюром способ записи химических связей в противоположность предложенному Купером изображению связей при помощи черточек позволяет увидеть, все ли валентные электроны каждого атома участвуют в соединении. То, что ранее было известно, но не поддавалось изображению (говорили о "не проявляющейся" или "скрытой" валентности) после принятия предложенного Ленгмюром способа изображения связей стало наглядным. Льюис и Ленгмюр ввели в науку также термин "изолированная пара электронов".
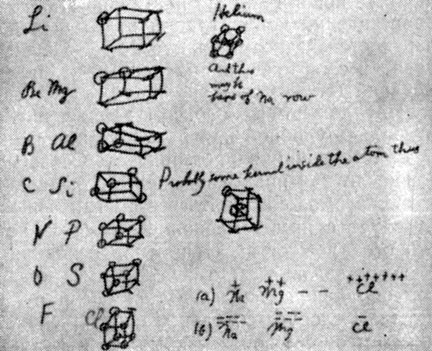
Страница из дневника Г. Н. Льюиса 1902 г., где он пишет о структуре атома
Созданный Льюисом и Ленгмюром способ записи формул соединений благодаря своей простоте и наглядности явился важным шагом вперед по сравнению со старыми структурными формулами. По отношению к формулам Купера электронные формулы,, введенные Ленгмюром и Льюисом, более гибки, они позволили преодолеть строгое подразделение всех соединений на гетерополярные и гомеополярные. Так завершился великий спор в классической химии между электрохимической дуалистической теорией Берцелиуса и унитарной теорией Кекуле25. Льюис и Ленгмюр своими представлениями наметили путь для дальнейшего теоретического обоснования химии. Только после этого был дан ответ на вопрос о природе сил, обусловливающих образование химических связей. Химический атом оказался чем-то похожим на "организм", отдельные "члены" которого упорядочены согласно определенным законам и действуют друг на друга определенными силами.
Однако основной областью работ Льюиса была физическая химия, а именно термодинамика26. Когда Льюис приступил к проведению самостоятельных научных работ в этой области, основные положения термодинамики были уже в общих чертах разработаны. Но в целом она находилась в довольно хаотическом состоянии, так что практическое проведение термодинамических расчетов наталкивалось на большие трудности. Льюис ввел ряд новых термодинамических вспомогательных величин, таких, как активность, летучесть, коэффициент активности и стандартная энтропия. Особенно близкой областью исследования для Льюиса была физическая химия растворов, преимущественно растворов электролитов. Льюис первым обнаружил, что коэффициент активности любого иона зависит лишь от полной ионной силы раствора. Это положение впоследствии было подтверждено П. Дебаем. Величину ионной силы раствора Льюис определял как сумму произведений концентраций отдельных ионов и квадратов их валентностей. Одновременно с Брёнстедем и Лаури Льюис сформулировал и свои идеи, направленные на развитие теории кислот и оснований (с. 264).
Предложенная Льюисом теория кислотно-основных свойств27 оказалась удобной при рассмотрении реакций кислот и оснований без учета влияния растворителя. Согласно представлениям Льюиса, кислотная природа веществ определяется способностью одного из его атомов соединяться с другим веществом таким образом, что образует с ним гомеополярную связь за счет электронной пары второго вещества. Напротив, основная природа вещества, по Льюису, связана с его способностью представить для образования гомеополярной связи электронную пару. Отсюда амфотерным веществом следует считать такое, молекула которого для образования гомеополярной связи может как принимать чужие, так и отдавать свои электронные пары.
В 1933 г. Льюису удалось доказать, что в определенных условиях путем электролиза может быть получена тяжелая вода.
Теория Косселя - Льюиса - Ленгмюра показала необходимость рассмотрения внутреннего движения в атоме для понимания природы сил химической связи, и поэтому работы этих ученых явились значительным вкладом в теорию классической химической атомистики. Она позволила понять, что наиболее простыми частицами материи являются не атомы, а электроны. Вращение электронов и их магнитные свойства вызывали к жизни новые вопросы. Так, теория валентности Льюиса могла быть интепретирована лишь с позиций волновой механики Гейзенберга и Шрёдингера и с привлечением принципа Паули: образование двухэлектронной связи представляет собой как бы спаривание двух магнитов - вращающихся подобно волчку электронов28. Создание общей теории межатомной связи, участия в ней "связывающих" и "разрыхляющих" электронов и создание теории направленных валентностей стало возможным лишь после работ Льюиса. Дальнейшее развитие это направление получило в трудах таких выдающихся ученых, как В. Гейтлер, Ф. Лондон, Ф. Хунд, Р. Малликен и Л. Полинг.
Независимо друг от друга В. Коссель и Г. Льюис развивали теорию химической связи, основанную на данных физики и химии того времени. Они оба по основной тематике проводимых исследований не были химиками. Их вклад в создание теоретических основ химии является примером тенденции развития науки в нашем столетии, когда уже сама тематика проводимых работ вызывает необходимость совместной деятельности ученых различных Специальностей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'