
Примечания к гл. VII
1 (Последней общественной работой Леблана было участие в качестве депутата в деятельности Совета старейшин Парижского департамента в 1789 г.)
2 (На основе разработанного Леблаиом способа промышленного получения соды (см. примечание6) в начале января 1791 г. между ученым, препаратором Дизе (разработавшим новый способ производства свинцовых белил) и управляющим делами герцога Орлеанского Ше был заключен договор о постройке завода на средства герцога Орлеанского. Завод был построен в Сен-Дени, близ Парижа. После того как в 1793 г. герцог Орлеанский был гильотинирован, а его собственность конфискована, патент Леблана национализировали. Обещанное ученому вознаграждение за это так и не было выдано. Лишь через семь лет автора патента вернули разоренный завод, а еще через четыре года суд постановил, что причитающееся Леблану вознаграждение компенсировано возвращенным ему заводом. Потеряв надежду получить средства на восстановление завода, Леблан застрелился 16 января 1806 г.)
3 (Особенно большое влияние на работы Леблана в этой области оказала статья французского химика и натуралиста Ж. К. де ла Метри (1743-1817) в издаваемом им "Журнале физики, химии, естественной истории и искусств". Де ла Метри предложил способ получения соды, основанный на следующих реакциях:
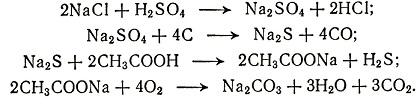
По этому способу работала фабрика, основанная в 1779 г. в парижском пригороде Жавель. Сам Леблан так говорил о влиянии работы де ла Метри: "Я нашел, что все вообще известные способы получения соды несовершенны, неполны и очень дороги... Гражданин де ла Метри поместил в "Журнале физики" свои замечания о разложении сульфата натрия при нагревании его с углем; он не : сомневается, что новые опыты обнаружат когда-нибудь средства полностью разлагать этот сульфат, называемый глауберовой солью. Я ухватился за эту идею и добавлением углекислой извести вполне достиг своей цели. Я сообщил ла Метри, что его замечаниям я обязан первым этим успехом, потому что они были поводом к моему последнему труду".)
4 (Кроме работ перечисленных авторов известны исследования ученых других стран, например Англии, Швеции, России. Так, имеются сведения об опытах английских химиков Кэра (1780 г.) и Б. Хиггинса (1781 г.). Последний "взял привилегию" на плавление глауберовой соли с углем и добавками свинца или железа. Однако эти способы не были осуществлены в промышленном масштабе в противоположность методу шведского ученого К. Шееле, разработанному в 1773 г. По его методу одно время довольно широко получалась каустическая сода по следующей реакции:
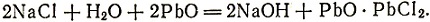
Еще раньше, в 1764 г., русский химик Кирилл Лаксман проводил опыты по получению соды из сульфата натрия восстановлением его древесным углем. Лаксмач доказал возможность применить сульфат натрия в качестве заменителя поташа и соды при варке стекла. В опытах Лаксмана сода получалась в результате следующих реакций:
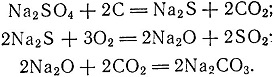
Этими реакциями попытались позже объяснить процессы, происходящие при исследованиях Лаксмана. Каково было действительное содержание соды в продукте, полученном Лаксманом, установить сейчас невозможно. Но если учесть, что содержание Na2CO3 в соде растительного происхождения во времена Лаксмана колебалось в пределах 7-25%, то можно допустить, что Лаксман имел основание называть образовавшийся плав содой, тем более что по своим свойствам она не уступала лучшим сортам испанской соды, полученной из золы.)
5 (В этом случае полученная после прокаливания сульфата натрия с железом и углем масса подвергалась действию атмосферного воздуха и при выщелачивании давала соду. Монах-бенедиктинец Малерб предложил этот способ в 1777 г,. а в 1779 г. близ Парижа был построен первый завод по производству соды именно этим способом (позднее этот завод стал работать по методу ла Метри, см. примечание 3).)
6 (Леблан начал работы по искусственному получению соды в 1787 г. сначала без особого успеха, но после знакомства со статьей ла Метри (см. примечание 3) в его работе произошел перелом; 25 сентября 1791 г. он получил патент на "Способ превращения глауберовой соли в соду" сроком на 15 лет. Основное внимание в нем было сконцентрировано на центральном звене процесса - получении содового плава, а в этом центральном звене - на химизме процесса (Леблана мало интересовало аппаратурное оформление). Новизна метода Леблана заключалась в следующем: 1) применение мела для образования соды; 2) установление оптимальных пропорций применяемых веществ; 3) нахождение наиболее эффективного режима работы печи (температура, продолжительность операции, степень перемешивания и т. д.). Схема реакций получения соды по способу Леблана такова:
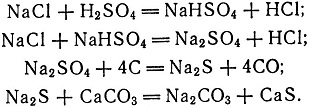
Первая реакция идет при обычной температуре, вторая - при небольшом нагревании, третья и четвертая - в одной стадии во вращающейся печи. Получающийся содовый плав содержит 40-45% Na2CO3, 30-33% CaS, 2-6% Na2S, 6-10% СаСО3, 4-7% кокса и другие примеси.)
7 (Особенно широко применялся хлор при процессах беления в текстильной промышленности, которая наиболее бурно развивалась в Англии. И первые патенты по получению хлора и по промышленному оформлению этого процесса принадлежали в основном английским исследователям. Первым из них был Р. Оксланд, затем Д. Джуллион и др. Основополагающее значение имели исследования Г. Дикона (1822-1876), который разработал процесс получения хлора из хлористого водорода на медно-марганцевых соединениях от начала и до конца, т. е. от выявления условий проведения процесса до его аппаратурного оформления. Эта работа заняла у Дикона довольно мало времени - от 1868 до 1873 г. Такой промышленный процесс получения хлора стал называться "диконовским хлорным процессом". Большую известность приобрел также метод получения хлора из хлористого водорода, разработанный другим английским ученым- В. Вслдоном (так называемый "велдоновский процесс"); последний применял в качестве катализатора тонко распыленную платину.)
8 (Английский инженер В. Госсаж был одним из первых, кто обратил внимание на проблему утилизации сульфида кальция. В 1837 г. он высказал предположение о возможности регенерации серы путем карбонизации сульфида кальция и получения таким образом сероводорода. Однако опыты, проводившиеся им в течение ряда лет, не дали желаемого результата.)
9 (Примерно через 20 лет после исследований Госсажа был разработан так называемый "способ Чанкса - Клауса" по регенерации серы в содовом процессе Леблана, основанный на следующих реакциях:
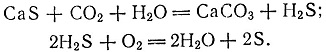
)
10 (Вообще следует отметить, что на примере усовершенствования леблановского процесса очень ярко проявилась характернейшая черта химической промышленности - стремление к максимальному использованию отходов производства.)
11 (История аммиачно-содового процесса начинается с 1838 г., когда англичане Г. Грей-Дьюар и Д. Хемминг взяли патент на производство соды по аммиачному методу, а в 1840 г. - второй патент, в котором были намечены все основные стадии современного аммиачно-содового процесса. Важным моментом в их работе было установление роли аммиака как переносчика углекислоты, постоянно находящегося в кругообороте процесса:
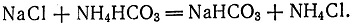
)
12 (Наиболее серьезная попытка осуществить аммиачно-содовый процесс в промышленности принадлежала химикам табачной фабрики в Париже Шлезингу и Ролланду, которые в 1854 г. основали в Путо (близ Парижа) содовый завод, проработавший два года: в первые 14 месяцев было произведено 86 т соды, в последующие 10 месяцев - 230 т. Их работами фактически закончился первый этап в развитии аммиачно-содового процесса, во время которого были установлены основные стадии процесса, их последовательность, выявлена роль аммиака, была осуществлена первая попытка организации непрерывного производства.)
13 (Следует подчеркнуть, что именно разработка аппаратуры позволила методу Сольве сначала конкурировать с методом Леблана, а затем и вытеснить его. Таким образом, если метод Леблана отличался от предшествующих методов своим химизмом, то метод Сольве - более глубокой и тщательной инженерной и технологической разработкой процесса.)
14 (В 1861 г. Сольве приступил к работам по практическому осуществлению аммиачно-содового процесса. Первый патент он взял в 1863 г. и тогда же построил небольшой содовый завод в городке Куйе, близ Шарлеруа (Западная Бельгия), который начал работать в 1863 г.)
15 (Хотя первый завод в Куйе работал успешно, но особого внимания способ Сольве вначале не привлек. Потребовалось целое десятилетие, чтобы он завоевал признание. В 1872 г. Сольве взял второй патент, где дал описание карбонизационной колонны и других аппаратов колонного типа, обеспечивающих непрерывность производственного процесса. Особенно большой успех принесла Сольве Венская выставка 1873 г. Вскоре после этого была начата постройка завода во
Франции, в Домбане (близ Нанси), который стал впоследствии одним из крупнейших содовых заводов в мире.)
16 (Следует отметить, что теоретическая разработка аммиачно-содового процесса долгое время отставала от его инженерно-технологического оформления. Поэтому многие патенты по этому способу, выданные в конце XIX в., почти не находили своего применения и не были осуществлены. Большую роль сыграли основы теории аммиачно-содового процесса, заложенные в начале XX в. русским химиком-технологом П. П. Федотьевым и его учениками.)
17 (Действительно, то, что мы понимаем под схемой Сольве, в том виде, как она сложилась к концу XIX в. и особенно в более позднее время, является плодом коллективного творческого труда многих конструкторов, работавших на содовых заводах Англии, Франции, России, Германии, США и других стран. Имена подлинных создателей современной технологической схемы аммиачно-содового процесса остались неизвестными.)
18 (Об истории производства соды, о самом производстве, а также о его теоретических основах см. следующую литературу: Гассен Ю. Ю. Очерки истории производства соды.- Л.- М.: Госхимиздат, 1951, 223 с; Никитинский Я. Я. Монография содового производства.- М.: Типолитография С. П. Архипова и К°., 1879, 263 с; Федотьев П. П. Содовое дело и связанные с ним производства. М.- Пг., Издание Ф. В. Шепанского, 1898, 333 с, Те-Пан - Го. Производство соды. Пер. с англ.- М.- Л.: Госхимиздат, 1948, 423 с.)
19 (Ныне Карл-Маркс-Штадт.)
20 (Винклер много занимался техническим газовым анализом и опубликовал по этому вопросу две монографии.)
21 (Такое полное совпадение свойств, предсказанных Менделеевым, с найденными позволило Винклеру сравнить эти предсказания Менделеева с предсказаниями Адамса и Леверье о существовании неизвестной в то время планеты Нептун, сделанными только на основании теоретических расчетов. Такое же сравнение проводили Ф. Энгельс, К. А. Тимирязев и др.)
22 (В то время серную кислоту производили камерным способом. Однако с момента открытия синтеза ализарина (1868 г.) и с началом его промышленного производства (1872 г.), с созданием промышленности искусственных красителей появилась потребность в больших количествах концентрированной серной кислоты, которую не мог дать камерный способ.)
23 (П. Филлипс-младший, владелец уксусной фабрики, одновременно с немецким химиком И. Дёберейнером стал изучать окисление сернистого ангидрида в серный на твердом контакте (катализаторе) - платине. В 1831 г. Филлипс получил первый патент на этот способ получения серной кислоты, поэтому иногда его называют родоначальником контактного способа получения серной кислоты.)
24 (Кроме И. Дёберейнера и Ф. Вёлера изучением контактного окисления сернистого ангидрида в серный занимались также ученые других стран: К. Блондо во Франции, И. Шнейдер в Бельгии, Г. Магнус в Германии и др. Наиболее многочисленные исследования проводил Дёберейнер примерно с 1823 по 1844 г., когда он имел в своем распоряжении значительные количества уральской платины; последняя в разных видах использовалась в качестве контактного вещества (катализатора).)
25 (Основной причиной низкого выхода (хотя для того времени он был не так уж плох) было ошибочное мнение Винклера о том, что для реакции должна быть взята стехиометрическая смесь сернистого газа и кислорода (или соответственно атмосферного воздуха). Хотя это и противоречило еще недостаточно широко распространенному тогда закону действующих масс К. Гульдберга и П. Вааге, но благодаря авторитету Винклера это мнение держалось довольно долго. Поэтому, чтобы иметь стехиометрическую смесь реагирующих газов, эту смесь получали термическим разложением камерной серной кислоты, что, естественно, было невыгодно.)
26 (В этом выступлении Винклер признал ошибочность своих прежних взглядов.)
27 (Вначале Винклер предполагал назвать этот элемент нептунием (см. примечание21), но оказалось, что такое же название было дано одному ложно открытому элементу незадолго до этого. Тогда Винклер назвал открытый им элемент германием, и Д. И. Менделеев поддержал его в этом.)
28 (О Клементе Винклере см. также: Фигуровский Н. А. Очерк общей истории химии. Развитие классической химии в XIX столетии.- М.: Наука, 1979, с. 394-397.)
29 (Книч считается создателем современного контактного способа получения серной кислоты.)
30 (Именно благодаря физико-химическому подходу к изучению процесса окисления диоксида серы Книч сделал правильный вывод об условиях проведения этого важного процесса. Исследование, основывающееся на физико-химических закономерностяк, Книч провел на рубеже XIX-XX вв. 19 октября 1901 г. он выступил с большим докладом на заседании Немецкого химического общества о работах, проведенных им на предприятиях концерна "Баденские анилиновые и содовые фабрики" в Людвигсхафене. Он сказал: "Серную кислоту по праву можно рассматривать как основу не только неорганической большой индустрии, но ввиду ее применения в различных отраслях в новое время также и как основу органической химии красителей...". Главнейшим выводом книги был следующий: "Если имеется стехиометрическая смесь SO2 + O2, то при исследовании реакции при различной температуре и различной силе газового потока видно, что не может быть достигнуто количественного превращения сернистого ангидрида в серный при технически возможных условиях... При применении смеси с избытком кислорода или сернистого газа удается одну составную часть при помощи действия массы вытеснить почти полностью другой составной частью благодаря тому, что она связывается с соответствующей частью избыточной составной части в серный ангидрид". Книч заключал из этого, что каждый контактный процесс получения серной кислоты протекает тем лучше, чем больше кислорода присутствует в газовой смеси по отношению к диоксиду серы. Поэтому формула SO2 + O = SO3, по Кничу, должна быть записана так: 2SO2 + O2 = 2SO3 + (n - 1)O2, где n не <2, т. е. n ≥ 2.)
31 (О работах К. Винклера и Р. Книча в области контактного получения серной кислоты см.: Лукьянов П. М. Производство серной кислоты методом контактного окисления.- М.: Гостехиздат, 1922; Малина И. К. Развитие представлений в области кинетики, катализа и реакционной способности.- М.: Наука, 1966, с. 123-149.)
32 (Количественные кинетические и каталитические исследования начались в конце XIX - начале XX в.)
33 (Химическая технология в то время только-только начинала становиться на научные рельсы. Очень большую роль в этом сыграла и молодая в то время физическая химия.)
34 (Георг Лунге (1839-1923) - выдающийся немецкий химик-технолог, автор многих важных технологических разработок в области сернокислотного, содового и других производств, а также автор трудов по химической технологии.)
35 (Исследования Габера в области термодинамики технических газовых реакций явились наиболее яркой страницей его научной деятельности. Здесь его исследования тесно переплетались с исследованиями другого крупнейшего немецкого ученого - В. Нернста, автора третьего начала термодинамики. Особенно интересным и плодотворным было "параллельное" изучение равновесия реакций синтеза и разложения аммиака (подробнее о работах Габера по осуществлению синтеза аммиака см. Малина И. К. Развитие исследований в области синтеза аммиака.- М.: Наука, 1973, 189 с).)
36 (Следует несколько подробнее остановиться на этом периоде деятельности Габера, поскольку разработанный им тогда каталитический синтез аммиака из элементов является не только самой яркой страницей в его жизни, но и важнейшим событием в области химии и химической технологии. Синтез аммиака позволил разрешить вековую "вожделенную" проблему связывания свободного азота. Деятельность Габера в этой области можно разделить на три периода:
- 1904-1905 гг. Первые исследования (совместно с Г. Ван-Оордтом) состояния равновесия аммиака. Это были только "примерочные" работы, показавшие возможность синтеза, но еще не давшие удовлетворительного выхода для практики.
- 1907-1909 гг. Работа Габера совместно с Р. Ле-Россиньолем. В этот период было применено повышенное давление (от 30 до 200 атм) и широкий диапазон температур (до 1000°С). Кроме того, были подобраны катализаторы- металлические осмий и уран. Выходы аммиака представляли уже практический интерес. Был сконструирован небольшой контактный аппарат. Главный результат работы этого периода - рекомендация на внедрение этого процесса в промышленности.
- 1910-1915 гг. В этот период была проведена детальная разработка условий проведения процесса, особенно его термодинамики. Кульминационный момент периода - введение в строй в сентябре 1913 г. первого завода синтетического аммиака в Оппау. В этот период в концерне "Баденские анилиновые и содовые заводы" были разработаны смешанные катализаторы синтеза аммиака (на основе железа с добавками тугоплавких и щелочных оксидов; лучшая смесь - Fe + Аl2O3 + K2O). Изысканием эффективных и дешевых катализаторов занималась группа ученых под руководством А. Митташа.
)
37 (За осуществление синтеза аммиака из элементов Габер был удостоен Нобелевской премии по химии в 1918 г., но из-за первой мировой войны премия ему была вручена лишь 2 июня 1920 г. Заключая свою речь при получении Нобелевской премии, Габер сказал: "Синтез аммиака из элементов - это процесс, принадлежащий классической физической химии... Значение найденного решения задачи состоит в том, что при нем не приходится вступать в область очень высоких температур и что поэтому расход угля по отношению к выходу аммиака значительно меньше, чем при других способах. Этого решения вполне достаточно для того, чтобы вместе с другими процессами связывания азота освободить нас от заботы, которую 20 лет назад создала опасность истощения естественных залежей селитры.
Быть может, решение это не окончательное. Существование азотных бактерий показывает нам, что природа в ее утонченных формах биологической химии знает и осуществляет другие возможности, которые она сначала скрывает от нашего взора. (Следует подчеркнуть, что Габер поистине гениально предвидел открытые теперь методы фиксации молекулярного азота в "мягких" условиях на комплексных соединениях переходных элементов, особенно советских школ М. Е. Вольпина и А. Е. Шилова.- Ред.) Пока нам приходится удовольствоваться тем, что уже теперь человечеству открываются новые багатства из возможности щедро удобрять поля и что химическая промышленность приходит на помощь сельскому хозяину, превращающему мирным трудом камни в хлебы".)
38 Хочется подчеркнуть, что создание Габером промышленного метода связывания азота - каталитического синтеза аммиака из элементов, хотя и направленное вначале на военные цели, сыграло огромную роль и для мирных целей. Габер писал в предисловии к переводу его речей на русский язык в 1924 г.: "Я буду искренне рад, если перевод этих речей послужит делу развития химии, так как восстановление Европы после разрушений, причиненных мировой войной, а также благосостояние и процветание человечества требуют сотрудничества всех народов, которые взаимно дополняют друг друга естественными богатствами и научным опытом".
39 (См. также: Капитонов Е. Н. Фриц Габер. Журнал ВХО им. Д. И. Менделеева, 1975, т. XX, с. 629-630 (номер посвящен лауреатам Нобелевской премии по химии).)
40 (Еще в конце XVIII в. английские химики Д. Пристли и Г. Кавендиш получали оксиды азота при пропускании электрической искры через определенный объем воздуха, но правильного толкования наблюдаемому ими явлению они не дали. Известные опыты по дуговому способу связывания азота провели в конце XIX в. У. Крукс, Д. Рэлей, Й. Лепель, Р. Сальвадори, Л. Невилль и др. Самая ранняя попытка разработки промышленного дугового связывания азота (1902 г.) принадлежит Ч. Брэдли и Д. Лове; по их способу был построен небольшой завод у Ниагарского водопада. Первым же дуговым способом связывания азота, который нашел широкое применение, стал способ X. Биркеланда и С. Эйде. По их способу в 1904 г. вблизи Осло была построена опытная установка, а в 1905 г. в Нотоддене - первая промышленная установка. Расход энергии при дуговом процессе составлял 60 000-70 000 кВт/ч на тонну связанного азота. Только 3% этой энергии использовались непосредственно на синтез оксидов азота.)
41 (Самой первой из известных реакций, с помощью которой "был связан" азот, явилась реакция образования щелочного цианида при нагревании, открытая К. Шееле в 1775 г.:
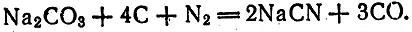
Первая установка по производству цианистого калия (с помощью катализатора) была построена во Франции в 1842 г. Наибольшее распространение имело получение цианидов щелочноземельных металлов, а не более дорогих щелочных металлов. Но затем произошла трансформация цианидного способа связывания азота в цианамидный благодаря работам Адольфа Франка и Никодима Каро. Исследования, проводившиеся в период 1895-1898 гг., привели к выводу, что при обработке азотом карбидов щелочноземельных металлов образуются и цианиды, и цианамиды, причем их соотношение зависит от условий реакции. Количество цианамида преобладало при применении в реакции карбида кальция:
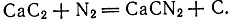
Сначала цианамиды считались лишь промежуточными продуктами. Но в 1901 г. Альберт Франк показал, что цианамиды являются хорошими удобрениями. Таким образом, оказалось, что способ, разработанный сначала для производства дешевых цианидов, можно использовать для получения соединений азота для нужд сельского хозяйства. Этот метод получил вскоре широкое распространение. Первая установка была построена в Италии в 1907 г., а затем стали строиться установки и в других странах. Но этот способ требовал большого количества энергии, особенно для стадии получения исходного продукта - карбида кальция:
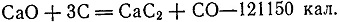
)
42 (В то время еще не был осуществлен каталитический синтез аммиака из элементов (см. примечание 36).)
43 (О термодинамических исследованиях состояния равновесия аммиака Нернcтом и Габером, а также о сравнении их работ и их влиянии подробнее см.: Малина И. К. Развитие исследований в области синтеза аммиака.- М: Наука, 1973, с. 56-78.)
44 (О деятельности Боша в осуществлении промышленного синтеза аммиака см.: Малина И. К. с. 81-86.)
45 (Хотя способ, осуществленный в Германии, и был назван способом Габера - Боша, однако его нельзя считать чисто германским способом. Каталитический синтез аммиака из элементов по своему характеру является "интернациональным процессом", так как было множество исследований ученых разных стран, направленных на его осуществление. Необходимо сказать, что осуществить синтез аммиака в промышленности было бы невозможно без известного уже к тому времени принципа подвижного равновесия, высказанного французским ученым А. Ле Шателье в его работах 1884 и 1888 гг. На основе этого принципа и были разработаны Габером первые термодинамические обоснования этой реакции. Известен патент самого Ле Шателье (1901 г.) по синтезу аммиака из элементов, включивший в себя основные моменты, которые потом легли в основу промышленного синтеза. Но отсутствие средств и поддержки деловых кругов не дали возможности Ле Шателье продолжить свои работы после того, как его аппарат взорвался во время одного из опытов. Кроме работ Ле Шателье известны также многочисленные исследования других ученых в этой области и большое количество патентов (например, французов Т. дю-Мотэ, Ш. Теллье и др.). Предварительной ступенькой явились также исследования английского ученого Э. Пермана (1904-1905 гг.).)
46 (Безусловно, значение решения проблемы связывания азота было хорошо известно в Германии. Поэтому исследования, проводимые в этом направлении, были фактически своеобразным социальным заказом. Особенно ярко это проявилось при разработке эффективных катализаторов синтеза аммиака, что явствует из многочисленных статей немецкого химика-каталитика и историка химии А. Митташа. Эти же мотивы звучат и в отдельных статьях В. Оствальда и К. Боша. См. также Журнал ВХО им. Д. И. Менделеева, 1975, XX, с. 645.)
47 (Ныне Мерзебург, ГДР.)
48 (О К. Боше (1874-1940) см.: Манолов. Т. II. - М.: Мир, 1976, с. 346-375; Манолов К. Карл Бош. Журнал ВХО им. Д. И. Менделеева, 1975, XX, с. 644 (номер посвящен лауреатам Нобелевской премии по химии).)
49 (О Ф. Бергиусе (1884-1949) см.: Крюков В. Н. Журнал ВХО им. Д. И. Менделеева, 1975, XX, с. 645.)
50 (О работах Ф. Фишера и Г. Тропша см.: Кузнецов В. И. Развитие учения о катализе.- М.: Наука, 1964, с. 102, 131, 283.)
Список сокращений названий книг, цитируемых в примечаниях
- Джуа - Джуа М. История химии: Пер. с итал.- М.: Мир, 1975, 477 с.
- Манолов. Т. 1 - Манолов К. Великие химики. Т. I: Пер. с болгар.- М.: Мир, 1977, 451 с.
- Манолов. Т. 2.- Манолов К. Великие химики. Т. 2: Пер. с болгар.- М.: Мир, 1977, 412 с.
- Меншуткин - Меншуткин Б. Н. Химия и пути ее развития.- Л.: Изд. АН СССР, 1936.
- Мусабеков, Черняк - Мусабеков Ю. С, Черняк А. Я. Выдающиеся химики мира. Биобиблиографический указатель.- М.: Книга, 1971, 360 с.
- Соловьев, 1971.- Соловьев Ю. И. Эволюция основных теоретических проблем химии.- М.: Наука, 1971, 400 с.
- Соловьев. Т. 1- Соловьев Ю. И. История химии. Развитие химии с древнейших времен до конца XIX в. Пособие для учителей.- М.: Просвещение, 1976, 367 с.
- Соловьев. Т. 2.- Соловьев Ю. И., Трифонов Д. Н., Шамин А. Н. История химии. Развитие основных направлений современной химии. Пособие для учителей.- М.: Просвещение, 1978, 352 с.
- Фигуровский. Т. 1 - Фигуровский Н. А. Очерк общей истории химии. От древнейших времен до начала XIX в.- М.: Наука, 1969, 456 с.
- Фигуровский. Т. 2 - Фигуровский Н. А. Очерк общей истории химии. Развитие классической химии в XIX столетии.- М.: Наука, 1979, 477 с.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'