
11. Получение карбонилов металлов и металлорганических соединений
Соединения, содержащие связи углерод - переходный металл, известны очень давно. Краситель - берлинская лазурь - Fe[Fe(CN)6]3, содержащий связи Fe - CN, был, может быть, первым примером таких координационных соединений. Французский химик Монд около 1890 г. получил карбонилы металлов: Ni(CO)4 и Fe(CO)5. И несмотря на это, настоящий расцвет в этой области начался только с 1950 г.; с тех пор было синтезировано огромное число соединений, содержащих связи углерод - переходный металл.
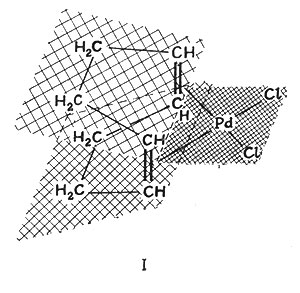
В этот класс соединений включены алкильные (например, (СО)5MnCH3) и арильные (например, [{P(C2H5)3}2Pt(C6H5)2]) соединения, содержащие σ-связи металл - углерод, большое число олефинов (I), в которых связь осуществляется совместным обладанием металлом и олефином π-электронов последнего (органическая молекула, содержащая двойные связи), и так называемые сандвичевы соединения (II), в которых атом металла находится между двумя плоскостями (или приблизительно так) циклических углеродных соединений. В последних соединениях связь может быть рассмотрена как разделение π-электронов органической молекулы с d- или гибридными орбитами металла.

Атомы металла в соединениях, содержащих связи углерод - металл, часто имеют аномально низкие формальные степени окисления, например металлы в карбонилах имеют степень окисления, равную нулю. Это, а также молекулярная природа соединений подсказывают, что карбонилы естественно получать восстановлением, часто в неводных средах. В дальнейшем будет видно, что многие подобные синтезы были осуществлены в диглиме* (diglime) [(СH3ОСН2СН2)2O], тетрагидрофуране 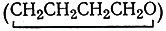 или в диэтиловом эфире - растворителях, в которых растворимы как реагирующие вещества, так и продукты реакции и которые менее воды подвержены восстановлению.
или в диэтиловом эфире - растворителях, в которых растворимы как реагирующие вещества, так и продукты реакции и которые менее воды подвержены восстановлению.
* (Диглим - диметиловый эфир этиленгликоля.- Прим. ред.)
Приготовление карбонилов металлов
Карбонилы металлов впервые были получены Мондом прямым взаимодействием газообразной окиси углерода с тонко размельченными металлами. Этим методом были приготовлены карбонилы железа, кобальта и никеля (49).
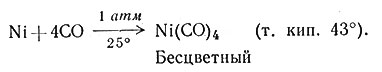
(49)
Образование Ni(CO)4 протекает быстро уже при комнатной температуре и давлении СО 1 атм. Более высокие температура и давление требуются для приготовления Co2(СО)8. В металлургии никель и кобальт часто разделяют методом Монда, используя образование Ni(CO)4 при средних температуре и давлении и последующее его разложение на металл и СО при сильном нагревании. Так как Co2(СО)8 образуется очень медленно при этих условиях и имеет к тому же небольшую летучесть, то кобальт остается, а газообразный Ni(CO)4 отгоняют.
Известно большое число карбонилов металлов. Их стехиометрический состав удобно объяснять при помощи правила эффективного атомного номера Сиджвика (разд. 2 гл. II). Для переходных металлов с четными атомными номерами можно ожидать образования простых мономерных карбонилов: Cr(СО)6, Fe(CO)5, Ni(CO)4. Более тяжелые члены подгрупп Cr и Fe также образуют мономерные карбонилы с предсказанным составом.
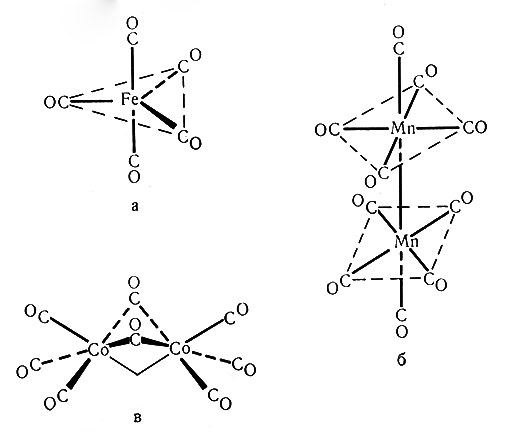
Рис. 27. Структуры. а - Fe(CO)5; б - Mn2(СО)10 и в - Co2(СО)8
У переходных металлов с нечетными атомными номерами в мономерных соединениях не может быть достигнут ожидаемый ЭАН. Молекула карбонила этих элементов всегда содержит больше одного атома металла и имеет связь металл - металл, которая осуществляется электронами, принадлежащими каждому атому металла: Mn2(СО)10, Co2(СО)8. Известны также другие полиядерные карбонилы металлов. На рис. 27 приведены структуры некоторых карбонилов. В 1959 г. был получен V(CO)6 - твердое соединение черного цвета, обладающее парамагнитными свойствами, разлагающееся при 70°. Оно является единственным мономерным карбонилом, не подчиняющимся правилу ЭАН. Соединение легко восстанавливается до [V(CO)6] , которое уже имеет 36 электронов вокруг атома металла (50).
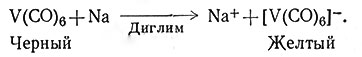
(50)
Карбонилы металлов обычно получают восстановлением солей металлов под высоким давлением в присутствии СО. Установлено, что для этой реакции эффективными являются многие восстановители. В реакции (51) восстановление проводят металлическим натрием, причем получается соль-ватированная натриевая соль V(CO)6, которая затем окисляется ионами H+ до V(CO)6 (52).
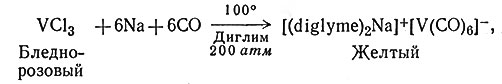
(51)
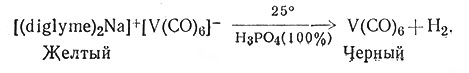
(52)
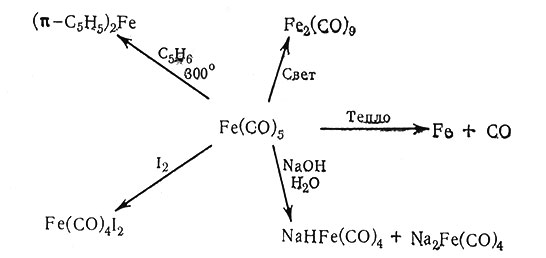
Рис. 28. Реакции с Fe(CO)5, иллюстрирующие химические свойства карбонилов металлов
Часто для восстановления используют другие активные металлы, например алюминий, а также металлорганические соединения, например C2H5MgBr и C6H5Li. Иногда карбонилы удобно получать восстановлением легко синтезируемого Fe(CO)5 (53).
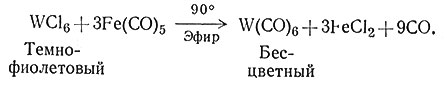
(53)
Окись углерода сама является прекрасным восстановителем и иногда она выполняет обе функции - восстановителя и лиганда (54).

(54)
Большое число различных соединений можно получить реакцией с карбонилами металлов. Рис. 28 на примере Fe(CO)5 иллюстрирует реакции, характерные для этих соединений.
Приготовление соединений олефинов с переходными металлами
В 1827 г. Цейзе, датский фармацевт, обнаружил, что этилен С2Н4 реагирует с [PtCl4]2- в разбавленной соляной кислоте с образованием соединений, содержащих как платину, так и этилен. Однако строение полученных продуктов было точно установлено только совсем недавно (III и IV).
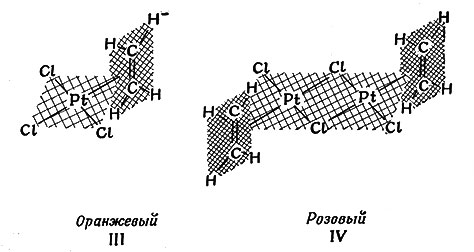
Комплекс построен в виде плоского квадрата со связью платина - этилен, направленной в середину между двумя атомами углерода. Связь в комплексах металла с этиленом (или другими олефинами) описывается теорией молекулярных орбит как перекрывание пустой орбиты металла с заполненной я-орбитой лиганда, делокализованной в молекуле этилена. Возможное образование π-связи между соответственно ориентированными заполненными орбитами металла и свободной разрыхляющей молекулярной орбитой олефина (рис. 29) обусловливает дополнительную устойчивость комплекса.
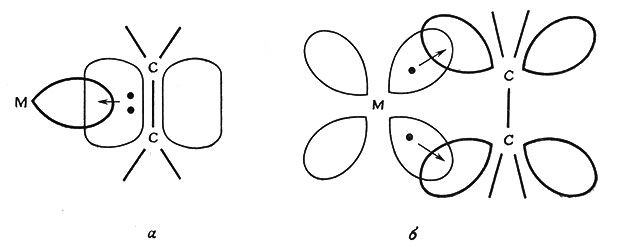
Рис. 29. Изображение связи металл - олефин в комплексах. а - σ-связь, образующаяся за счет перекрывания π-MO олефина с орбитой металла; б - π-связь, образующаяся за счет перекрывания π*-разрыхляющей МО олефина с d-орбитой металла
В последние годы было получено большое число подобных соединений с разнообразными олефинами. Наиболее устойчивые соединения получались с теми олефинами, в молекулах которых содержались две двойные связи, расположенные так, что обе они могли образовать связь с одним и тем же атомом металла. Примером молекул такого типа является циклооктадиен (55). Соединения олефинов обычно получают прямой реакцией олефина с солью металла или его комплексом.
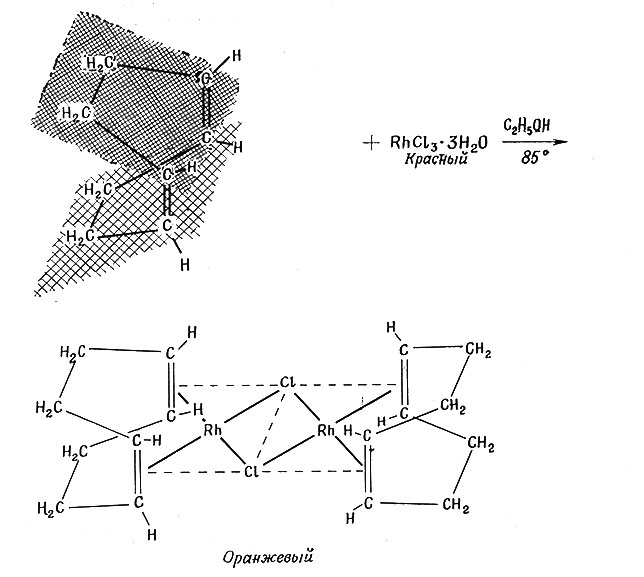
(55)
Получение сандвичевых соединений
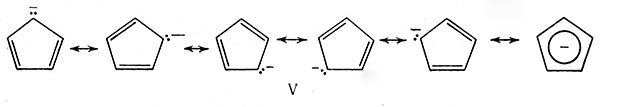
Начиная с 1950 г. было получено большое число соединений переходных металлов, в которых атом металла являлся как бы "прослойкой" между двумя плоскостями органических молекул -"ломтиков хлеба" в молекуле - "сандвиче". Для получения таких соединений успешно применяли атомы различных металлов и органические молекулы; но наиболее устойчивые комплексы образовывал анион циклопентадиена С5Н5- (V).
Первым синтезированным соединением этого типа был ферроцен [бис-π-циклопентадиенил)железо(II)] (II) - оранжевое кристаллическое вещество, кипящее без разложения при 249° и не взаимодействующее с водным раствором NaOH и концентрированной соляной кислотой. Соединение диамагнитно и неполярно. На основании таких химических и физических свойств ему было приписано строение "сандвича" (II), что было подтверждено рентгеноструктурными исследованиями.
Правило ЭАН Сиджвика очень полезно при получении сандвичевых и олефиновых соединений. Ион С5Н5, как и молекулу бензола, рассматривают в качестве шести-электронного донора, а этилен - двухэлектронного. Присоединение лигандов, отдающих соответствующее число электронов атому металла для сообщения ему ЭАН, равного числу электронов в атоме инертного газа, часто приводит к образованию устойчивых соединений, например Fe(C5H5)2, Mn(C5H5)(C6H6), Cr(C6H6)2.
В молекуле ферроцена анион циклопентадиена ведет себя подобно ароматической органической молекуле.
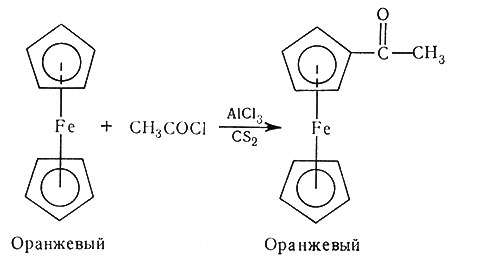
(56)
Поскольку ферроцен вполне устойчив, можно осуществить реакции в цикле, характерные для ароматических систем без разрушения связи с атомом металла (56). Химия ферроцена и получение новых его производных широко развивается.
Циклопентадиенильные сандвичевы соединения часто получают, проводя реакцию хлорида металла с циклопентадиенилом натрия (57).

(57)
Дибензолхром Cr(С6Н6)2 лучше всего получать по схеме реакции (58). Получающееся промежуточное соединение Cr(I) затем обрабатывают сильным восстановителем, таким, как гидросульфит-ион (S2O2-4). Дибензолхром и другие бензольные сандвичевы соединения значительно менее устойчивы многих циклопентадиенильных соединений; они легче окисляются и разрушаются в тех условиях, в которых осуществляют большинство реакций.
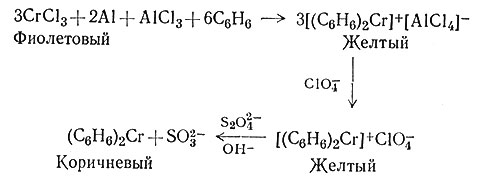
(58)
Получение соединений с σ-связью переходный металл - углерод
Соединения переходных металлов, содержащие алкильные и арильные группы, углерод которых связан с атомом металла а-связью, до недавнего времени были очень редки. Установлено, что при наличии таких лигандов, как СО, С5Н5 или фосфинов, сильно возрастает способность переходного металла образовывать металлорганические соединения с σ-связью. Соединения с σ-связью переходный метал - углерод часто получают реакцией обмена, одним из продуктов которой является металл - органическое соединение, другим - простая соль (59, 60).
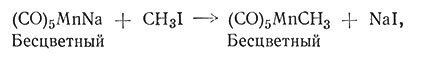
(59)
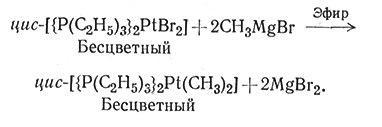
(60)
Недавно были получены соединения переходных металлов с фторуглеводородами; обычно они более устойчивы, чем соответствующие углеводороды (61, 62).
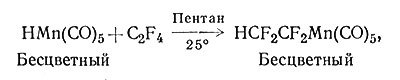
(61)
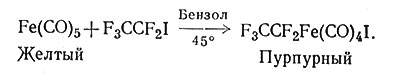
(62)
В этом разделе затронуты вопросы только химии металл-органических соединений переходных металлов. Однако в этой области в настоящее время проведено много интересных исследований. Химия этих соединений имеет большое практическое значение, так как предполагают, что реакции этих соединений оказывают существенное влияние на активность катализаторов - переходных металлов в разнообразных органических системах.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'